قطعا شما هم شنیده اید که جهان تمایل دارد به بالاترین میزان آنتروپی یا بی نظمی برسد.
اما آیا با تعریف دقیق و علمی این مفهوم آشنا هستید؟ آیا برای شما هم جالب است بدانید علت این گزاره درباره جهان هستی چیست؟
با ما همراه باشد که بدانید این کمیت در فعالیت های روزمره و طبیعت چه میزان اهمیت دارد.
1# آنتروپی چیست؟
2# نقش آنتروپی در زندگی روزمره
در طول روز چه فعالیت هایی در آشپزخانه منجر به افزایش بی نظمی می شوند؟
- یخ شدن آب
- حل شدن شکر و نمک در آب
- درست کردن پاپ کرن
- قل قل کتری در هنگام جوشیدن آب
باز هم فکر کنید، حتما متوجه مثال های دیگری شده اید که تنها به آشپزخانه ختم نمی شوند.

گفته می شود آنتروپی یعنی اندازه گیری بی نظمی که از ویژگی های سیستم های ترمودینامیکی است.
ولی این بی نظمی با معنی معمول این واژه که در ذهن تداعی می شود، تفاوت دارد.
آیا فکر می کنید دچار سردرگمی شده اید؟ کمی صبر کنید.
این کمیت همان اندازه گیری انرژی است که به حجم وابسته است. چطور؟
قانون دوم ترمودینامیک کمک می کند که بدانیم چرا جهان همواره پویا و در حرکت است.
چرا تابه گرم خنک می شود؟
چرا سوخت باعث حرکت وسایل نقلیه می شود؟
چرا آب در آبشار نیاگارا به سمت پایین سقوط می کند؟
این کمیت در صنایع شیمیایی جهان را در نیم قرن گذشته از گرسنگی نجات دهد.
ولی این تمام ماجرا نیست.
3# نظم یا بی نظمی
این اشتباه در مورد بی نظمی در سال 1898 توسط یک فیزیکدان نظری باهوش رخ داد.
تلاش او جهت تفسیر این کلمه به زبان ساده اشتباه بود؛ زیرا بعد از مرگ او مفهوم جدیدی از رفتار مولکولی ارائه شد.
در اواسط سال 1920 با اعلام گسسته بودن تراز های انرژی استفاده از تفسیر نظم یا بی نظمی به سرعت کهنه شد.
میزان تمایل به پخش شدن انرژی پتانسیل همان بی نظمی است.
مولکول ها تمایل دارند که با پخش کردن انرژی خود این کمیت را افزایش دهند.
هرچه فضای خالی بیشتری وجود داشته باشد افزایش آنتروپی بیشتر می شود.
در یک واگن شلوغ بی نظمی بیشتر است یا یک واگن خلوت؟ این همان تفسیر اشتباه در مورد بی نظمی است.
اگر فضای بیشتر در واگن باشد امکان انتخاب های زیادی جهت نشستن وجود دارد.
ولی اگر شلوغ باشد مجبور هستید در یک جا بمانید و هم چنان انرژی پتانسیل خود را افزایش دهید.
تا زمانی که این انرژی به جنبش تبدیل نشود آنتروپی ثابت مانده و یا حتی کم می شود.
4# قانون دوم ترمودینامیک
طبق قانون دوم ترمودینامیک در هر چرخه آنتروپی سیستم ثابت مانده و یا افزایش می یابد.
اگر چرخه برگشت پذیر باشد، این کمیت تغییر نمی کند ولی
در غیر این صورت سیستم با کاهش آن مواجه است. با چند مثال فرآیند برگشت پذیر و برگشت ناپذیر را توضیح می دهیم.
1-4# فرآیند برگشت پذیر و برگشت ناپذیر
پختن نیمرو یک فرآیند برگشت ناپذیر است. زیرا بعد از پخت دیگر به شکل اولیه تخم مرغ باز نمی گردد.
در این فرآیند ها با تغییر ساختاری روبرو هستید.
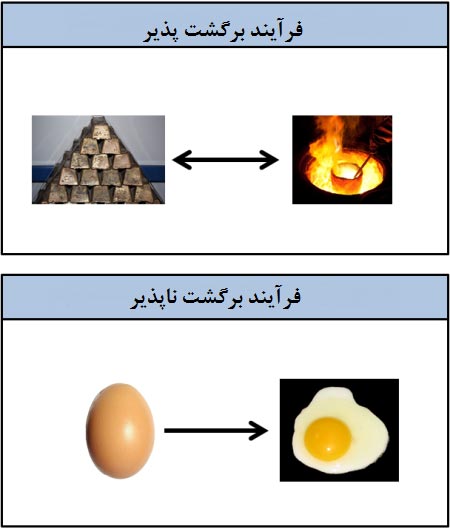
در مواردی مانند ذوب فلزات امکان بازگشت به حالت جامد وجود دارد پس یک فرآیند برگشت پذیر محسوب می شود.
به منظور درک بهتر این قانون در زندگی روزمره، مثال هایی که در ابتدا اشاره کردیم را توضیح می دهیم.
اتم ها در یک تابه داغ با سرعت زیادی در کنار هم می جنبند و به دلیل گرمای شعله گاز تابه گرم می شود.
بنابراین بعد از خاموش کردن گاز مولکول های موجود در هوای سرد بالای تابه جنبش کمی دارند.
این موضوع باعث می شود آنتروپی کمی داشته باشند که به افزایش آن تمایل دارند.
به همین دلیل گرمای تابه را دریافت و آنتروپی شان را افزایش می دهند و تابه کم کم خنک می شود.
مولکول های آب در بالای آبشار نیاگارا دارای انرژی پتانسیل زیادی هستند.
اگر آن ها به پایین پرت شوند پخش شده یا به رودخانه ریخته می شوند و این همان افزایش بی نظمی است.
اگر لاستیک ماشین سوراخ نشود این کمیت در هوا افزایش پیدا نمی کند.
اگر جرقه ای نباشد ماشین یک مهندس به حرکت در نمی آید.
از دیگر مثال های ملموس در این زمینه پاشیدن اسپری خوشبو کننده در گوشه اتاق است.
آیا مولکول های عطر در همان گوشه باقی می ماند؟
خیر. مولکول های عطر تمام فضای اتاق را پر می کنند.
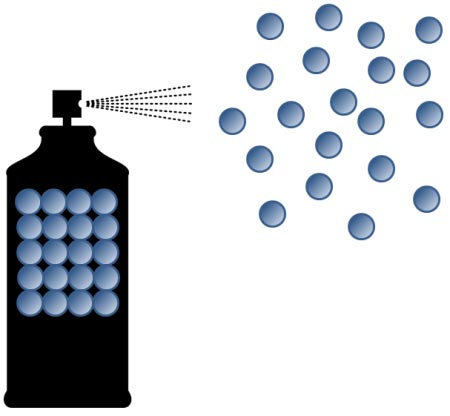
یعنی عطر از محلی به محل دیگری پخش می شود که بی نظمی را افزایش دهد.
5# آنتروپی به چه کمیت هایی وابسته است؟
همان طور که در مثال ها متوجه شدید، این کمیت به حجم و دما بستگی دارد.
زیرا همواره انرژی گرمایی سبب جنبش مولکول ها می شود که این اتفاق افزایش بی نظمی را به دنبال دارد.
هم چنین اشاره شد هر کجا که فضای خالی بیشتری باشد بی نظمی نیز بیشتر خواهد بود.
بنابراین اگر دو ظرف با گنجایش های متفاوت داشته باشید و
هر دو را به یک میزان گرما دهید. انتظار دارید کدام ظرف بی نظمی بیشتری داشته باشد؟
بله، ظرفی که بزرگتر است مکان های خالی بیشتری جهت حرکت مولکول ها دارد و
بی نظمی در این ظرف بیشتر خواهد بود.
6# زمان و ترمودینامیک
زمان همواره به سمت جلو حرکت می کند. گذشته پشت سر، ثابت و تغییر ناپذیر بوده و
آینده پیش رو بدون ثبات و غیرقابل پیش بینی است. بیشتر اتفاقات غیر قابل بازگشت هستند.
جهت یک سویه و عدم تقارن در زمان به عنوان پیکان زمان شناخته می شود.
قانون دوم ترمودینامیک بیان می کند بی نظمی در هر سیستم بسته ای با گذشت زمان افزایش پیدا خواهد کرد یا در آخر ثابت خواهد ماند.
دنیا به منظور رسیدن به تعادل پیش می رود.
تولد و مرگ همان تعادل دنیا محسوب می شوند. اگر زمان نبود تولد و مرگ نیز وجود نداشت.
در این صورت تعادل بین جرم و انرژی بر هم زده شده و
مفهوم این واژه بی معنا می شود. این کمیت می تواند نقطه تمایزی بین گذشته و آینده باشد.
7# معادله تغییرات آنتروپی
اگر فرآیند برگشت پذیر باشد، تغییرات آنتروپی از تقسیم میزان گرما بر دما به دست می آید.
در معادله زیر Q میزان دمای جذب شده، T دما و S نماد این کمیت است.
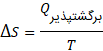
این معادله همان میزان انرژی به هدر رفته در سیستم است.
هرچه میزان این کمیت بالاتر باشد یعنی اتلاف انرژی وجود دارد.
بنابراین انرژی کمتری به منظور راه اندازی سیستم در اختیار خواهید داشت.
وقتی سیستم به تعادل رسیده باشد، یعنی این پارامتر به بیشترین مقدار خود رسیده است.
در این حالت سیستم دیگر کار انجام نمی دهد.
اگر سیستم را یک موجود زنده فرض کنیم، این موجود زنده وقتی به بیشترین میزان بی نظمی برسد خواهد مرد.
8# شاه کلید در فهم آنتروپی
برای پی بردن به بی نظمی در سیستم های متفاوت به نکات و راهکارهای کلیدی نیاز دارید.
در ادامه با برخی از شاه کلید های فهم آنتروپی آشنا می شوید:
- اندازه گیری بی نظمی و تصادفی بودن سیستم ها
- وابستگی به حجم سیستم و دما
- نماد S، واحد (ژول بر کلوین)
- دارای مقادیر منفی و مثبت؛ طبق قانون دوم ترمودینامیک، بی نظمی زمانی کاهش می یابد که در سیستم دیگری افزایش یافته باشد.
کلام آخر
اگر به اطراف خود با دقت بیشتری توجه کنید پدیده های مختلفی وجود دارند که به سبب آنتروپی رخ می دهند.
حتی در ساده ترین فعالیت های زندگی قانون دوم ترمودینامیک در جریان است.
پدیده هایی مانند حل شدن شکر در چای، خروج هوا از بادکنک سوراخ، ذوب شدن برف و… به دلیل افزایش بی نظمی و
ترجیح سیستم ها به رسیدن به یک نقطه بالاتر رخ می دهند.
آنتروپی همان میزان اتلاف انرژی را نشان می دهد.
جهت درک مفهوم این کمیت کافی است کمی عمیق ولی ساده به اتفاقات پیرامون خود فکر کنید.
البته معادلات آن همواره به منظور آسان سازی توجیه پدیده فرض هایی دارند که شاید خارج از چهار چوب های واقعی باشند.
نظرتون درباره این مقاله چیه؟
ما رو راهنمایی کنید تا اون رو کامل تر کنیم و نواقصش رو رفع کنیم.
توی بخش دیدگاه ها منتظر پیشنهادهای فوق العاده شما هستیم.




مقاله مختصرومفید درمورد انتروپی بود .
دانشجوی ترم سوم کارشناسی ارشد امار دانشگاه صنعتی اصفهان
سلام جناب رحیم زاده
از اینکه شما همراه ما هستید بسیار خرسندیم و رضایت شما مایه مباهات ماست
موید باشید
مقاله عالی وبی نظیراست ممنونم . عباس اعتزازیان دکترای ریاضیات وفلسفه علم
سلام جناب دکتر اعتزازیان
همراهی و لطف بیکران شما مایه افتخار و مباهات ماست.
موفق باشید
سلام و وقت بخیر ، در این عبارت متن به نظرتون کلمه کاهش نباید با افزایش جایگزین بشه؟ “طبق قانون دوم ترمودینامیک در هر چرخه آنتروپی سیستم ثابت مانده و یا کاهش می یابد.”
سلام جناب مهندس
ضمن تشکر از همراهی شما با سایت نماتک از شما بسیار سپاسگزاریم که این موضوع رو اطلاع دادید این مورد رو بررسی میکنیم و در صورت اشتباه بودن متن ویرایش خواهد شد.
موفق و پیروز باشید.
درست نوشته شده، طبق قانون دوم ترمودینامیک در هر چرخه آنتروپی سیستم ثابت مانده و یا افزایش می یابد
سلام همراه عزیز
ممنون از محبت تون بابت بررسی و توضیح این موضوع
موفق باشید
کارتون خوب بود برای توضیح آنتروپی
همراه گرامی سلام
ممنونیم که نظر محبت آمیزتون رو در سایت ما درج کردید و خرسندیم که این محتوای آموزشی برای شما مفید واقع شده
موفق باشید