اگر در حال مطالعه شیمی هستید، احتمالاً باید بدانید که هیدرات چیست و چه نقشی ایفا میکند.
آب، رایجترین ماده شیمیایی روی زمین، به صورت بخار آب در جو یافت میشود.
برخی از مواد شیمیایی، هنگامی که در معرض آب موجود در جو قرار میگیرند، به طور برگشتپذیر آن را یا روی سطح خود جذب میکنند یا در ساختار خود قرار میدهند و کمپلکسی را تشکیل میدهند که در آن آب عموماً با کاتیون موجود در مواد یونی پیوند برقرار میکند.
آبی که در حالت دوم وجود دارد، هیدرات یا آب تبلور نامیده میشود.
این ترکیبات شیمیایی، خواص متفاوتی را ارائه میدهند.
درک خواص و رفتار هیدراتها نهتنها برای تحقیقات علمی؛ بلکه برای کاربردهای عملی در صنایع مختلف نیز مهم است.
در این مقاله سعی بر آن داریم تا پاسخ مناسبی به این سؤال که هیدرات چیست، داده و انواع هیدرات و ویژگیهای آنها را موردبحث قرار دهیم.
1# هیدرات چیست؟

در اولین گام این سؤال مطرح است که هیدرات چیست؟
هیدرات ترکیبی است که حاوی مولکولهای آب متصل به ساختار خود است.
این ترکیبات معمولاً با ترکیب یک نمک یونی با آب تشکیل میشوند و بسته به تعداد مولکولهای آب متصل، میتوانند درجات مختلفی از هیدراتاسیون داشته باشند.
به عنوان مثال، یک هیدرات رایج، سولفات مس پنتاهیدرات (CuSO4·5H2O) است که به ازای هر مولکول سولفات مس، پنج مولکول آب دارد.
مثال دیگر، کلرید کلسیم دی هیدرات (CaCl2·2H2O) است که به هر مولکول کلرید کلسیم، دو مولکول آب متصل است.
وجود این مولکولهای آب در ساختار هیدراتها، خواص منحصربهفردی مانند افزایش حلالیت و پایداری را به آنها میدهد.
به عنوان مثال، برخی از هیدراتها ممکن است هنگام گرم شدن به دلیل از دست دادن مولکولهای آب متصل به خود، رنگ یا بافت خود را تغییر دهند.
علاوه بر این، هیدراتها میتوانند نقش مهمی در بسیاری از فرایندهای صنعتی مانند واکنشهای آبگیری و کاتالیز ایفا کنند.
آنها را میتوان در انواع ترکیبات شیمیایی از جمله مواد معدنی، دارویی و مواد صنعتی یافت؛ اما روند تشخیص ترکیب هیدرات چیست؟
برای تعیین اینکه آیا یک ترکیب هیدرات است یا خیر، دانشمندان از روشهای مختلفی از جمله کریستالوگرافی اشعه ایکس، آنالیز وزنسنجی حرارتی (TGA) و گرماسنجی روبشی تفاضلی (DSC) استفاده میکنند.
این تکنیکها به محققان اجازه میدهند تعداد مولکولهای آب متصل به ساختار ترکیب را شناسایی کنند.
از سوی دیگر، هیدراتها با استفاده از قوانین نامگذاری خاص بر اساس ترکیب آنها نامگذاری میشوند.
نام معمولاً شامل نام یا نماد کاتیون است و به دنبال آن اگر فقط یک مولکول وجود داشته باشد، “هیدرات” یا اگر چندین مولکول وجود داشته باشد، “n-هیدرات” میآید.
درک تعریف و قراردادهای نامگذاری هیدراتها برای کسانی که شیمی را مطالعه میکنند یا با این نوع ترکیبات در صنایع مختلف کار میکنند، ضروری است.
با درک چگونگی تشکیل و تعامل این ترکیبات با سایر مواد، دانشمندان میتوانند فناوریهای جدیدی را توسعه داده و محصولات موجود را برای کاربردهای متعدد بهبود بخشند.
اکنون با مفهوم هیدرات آشنا شدیم، حال این سؤال به ذهن میرسد که روند تشکیل هیدرات چیست؟
2# روند تشکیل هیدراتها

هیدراتها میتوانند از طریق جذب مستقیم بخار آب از هوا به یک ماده تشکیل شوند.
این فرایند میتواند از طریق کئوردیناسیون رخ دهد، جایی که مولکولهای آب مستقیماً به یک یون فلزی پیوند میخورند یا از طریق تبلور، جایی که مولکولهای آب در ساختار شبکه ترکیب ادغام میشوند.
به عنوان مثال، در نمک اپسوم هیدراته (MgSO4·7H2O)، مولکولهای آب با یون منیزیم کئوردیناسیون میشوند، در حالی که در سولفات آهن (II) هپتاهیدرات (FeSO4·7H2O)، مولکولهای آب هم با یونهای آهن کئوردیناسیون میشوند و هم پیوندهای هیدروژنی را در شبکه کریستالی تشکیل میدهند.
3# علت تشکیل هیدرات

مانند هر چیز دیگری در شیمی، دلیل اینکه بسیاری از ترکیبات یونی تمایل به پیوند با تعداد مشخصی از مولکولهای آب دارند، انرژی است.
طبیعت همیشه به دنبال بهحداقلرساندن انرژی است؛ ولی اثر این مفهوم در هیدرات چیست؟
بسیاری از نمکها وقتی در ساختارهای بلوری منظم سازماندهی میشوند، پایدارتر هستند، ساختارهایی که در آنها هر ترکیب یونی به شکلی منظم و قابلتنظیم قرار گرفته است؛ اما بسیاری از بلورهای مشابه نمیتوانند تشکیل شوند مگر اینکه چند مولکول آب از طریق پیوند هیدروژنی بین مولکولها پل تشکیل دهند.
اگر کمی در مورد انرژیها بهخاطر داشته باشید، به یاد خواهید آورد که هر رویداد خودبهخودی، مانند تشکیل خودبهخودی یک بلور هیدراته، باید تغییر انرژی گیبس منفی، ΔG، داشته باشد.
به یاد داشته باشید که ΔG = ΔH – TΔS که در آن ΔH تغییر آنتالپی و ΔS تغییر آنتروپی است.
ازآنجاکه این بلور آنتروپی (بینظمی) بسیار کمتری نسبت به یک جامد آمورف (بدون ساختار یا آشوبناک) دارد، ΔS منفی است.
این بدان معناست که مثلاً تبلور CuSO4 · 5H2O باید “محرک آنتالپی” باشد، و همینطور هم هست.
ΔH منفی و بهاندازه کافی بزرگ است تا فقدان آنتروپی را جبران کند، بنابراین این فرایند خودبهخودی است.
4# خواص و رفتار هیدراتها

هیدراتها با توانایی خود در آزاد کردن مولکولهای آب هنگام گرمشدن، فرایندی که به عنوان دهیدراتاسیون شناخته میشود، مشخص میگردند؛ اما اثر این عمل در هیدرات چیست، این از دست دادن آب میتواند منجر به تغییراتی در ظاهر فیزیکی، مانند رنگ و بافت و تغییر در ساختار کریستالی شود.
ترکیبات بیآب حاصل اغلب در آب بسیار محلول هستند و ممکن است در معرض رطوبت، شکل هیدراته اولیه خود را بازیابند.
برخی از هیدراتها میتوانند در هوای خشک از طریق شوره زدن، آب از دست بدهند، در حالی که برخی دیگر جاذب رطوبت هستند و به طور فعال رطوبت را از هوا جذب میکنند.
بر این اساس، مواد خشککننده مانند پنتوکسید فسفر (P2O5) و کلرید کلسیم بیآب (CaCl2) برای جذب رطوبت استفاده میشوند.
مواد رقیقکننده، مانند هیدروکسید سدیم (NaOH)، میتوانند آنقدر آب جذب کنند که در آب جذب شده و حل گردند.
5# انواع مختلف هیدراتها براساس نحوه پیوند

هیدراتها را میتوان بر اساس ماهیت مولکولهای آب و نحوه پیوند آنها با ترکیب، به انواع مختلفی طبقهبندی کرد.
در مورد اینکه این دستهبندی انواع هیدرات چیست، به موارد زیر میتوان اشاره کرد:
- رایجترین نوع، هیدراتهای یونی است که از یک ترکیب یونی با مولکولهای آب با پیوند سست تشکیل شدهاند.
این هیدراتها اغلب ساختار بلوری دارند و بسته به شرایط میتوانند بهراحتی آب از دست بدهند یا به دست آورند. - نوع دیگر، هیدراتهای کووالانسی حاوی مولکولهای آب با پیوند کووالانسی هستند و معمولاً توسط ترکیبات آلی مانند الکلها و اسیدهای کربوکسیلیک تشکیل میشوند.
این هیدراتها به دلیل ماهیت قطبی خود، در حلالهای قطبی محلولتر هستند. - نوع دیگری از هیدرات، هیدرات پیچیده است که حاوی یونهای فلزی یا یونهای چند اتمی است که توسط چندین مولکول آب احاطه شدهاند.
این امر یک ساختار شبکه بلوری پیچیده ایجاد میکند که میتواند منجر به خواص فیزیکی منحصر به فردی مانند رنگ یا مغناطیس شود.
هیدراتهای مولکولی از ترکیبات غیر یونی مانند قندها یا پروتئینهایی تشکیل شدهاند که با مولکولهای آب اطراف خود پیوندهای هیدروژنی تشکیل میدهند.
این نوع هیدراتها نقشهای مهمی در فرایندهای بیولوژیکی مانند هضم و عملکرد سلولی دارند.
درک این انواع مختلف هیدراتها برای شناسایی دقیق ترکیبات در واکنشهای شیمیایی و پیشبینی رفتار آنها در شرایط مختلف ضروری است.
6# انواع مختلف هیدراتها براساس مواد پیوند

انواع هیدراتها را میتوان براساس مواد حاضر در پیوند نیز دسته بندی کرد.
در این دسته بندی سه نوع هیدرات وجود دارد:
- هیدرات معدنی
- هیدرات آلی (ارگانیک)
- هیدراتهای گازی (یا کلاترات)
اکثر هیدراتها، هیدراتهای معدنی هستند و بیشتر مورد استفاده و مطالعه قرار میگیرند؛ اما ویژگی این انواع هیدرات چیست؟
1-6# هیدراتهای معدنی
هیدراتهای معدنی همانهایی هستند که تاکنون در موردشان بحث کردهایم.
در هیدراتهای معدنی، مولکولهای آب فقط به صورت سست به ترکیب متصل شدهاند و هیچ واکنش شیمیایی وجود ندارد.
مولکول(های) آب را میتوان بهراحتی از ترکیب، مثلاً با گرم کردن، جدا کرد. “بیآب”، به هیدرات معدنیای اشاره دارد که تمام مولکولهای آب خود را از دست داده است.
بیشتر هیدراتها از هیدراتهای معدنی تشکیل شدهاند.
2-6# هیدراتهای آلی
هیدراتهای آلی از طریق هیدراتاسیون که عبارت است از افزودن آب یا اجزای آن به یک ترکیب آلی از طریق یک واکنش شیمیایی تشکیل میشوند.
به عبارت دیگر، یک هیدرات آلی زمانی ایجاد میشود که یک مولکول آب به یک گروه کربونیل از یک آلدهید یا کتون اضافه شود.
مانند هیدراتهای معدنی، برخی از هیدراتهای آلی میتوانند بدون تغییر در ساختار تشکیل شوند.
3-6# هیدراتهای گازی (کلاترات)
در هیدراتهای گازی، مولکول گاز که معمولاً متان است، توسط یک چارچوب سست ساخته شده از مولکولهای آب در جای خود نگه داشته میشود.
در ساختار این نوع هیدرات، “قفس” مولکولهای آب، میزبان نامیده میشود، در حالی که گاز داخل آن، مولکول مهمان نامیده میشود.
7# فرمول کلی هیدرات
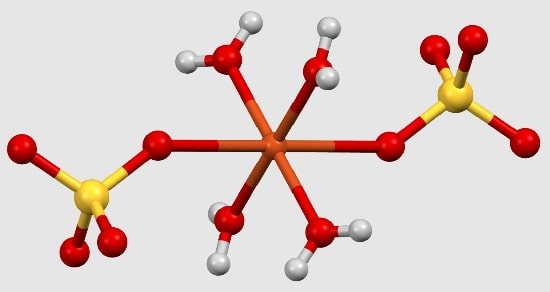
فرمول کلی هیدرات کاملاً ساده و سرراست است.
این فرمول از دو بخش فرمول شیمیایی ترکیب و تعداد مولکولهای آب متصل به آن تشکیل شده است.
فرمول شیمیایی نشان دهنده ترکیب بیآب است، درحالیکه یک نقطه به دنبال آن تعداد مولکولهای آب نشان میدهد که چه تعداد آب در هر مولکول وجود دارد.
به عنوان مثال، اگر سولفات مس پنتاهیدرات (CuSO4·5H2O) را در نظر بگیریم، فرمول کلی آن CuSO4 با پنج مولکول آب متصل به آن خواهد بود.
این بدان معناست که برای هر مولکول سولفات مس موجود، پنج مولکول آب با نسبت خاصی به آن متصل هستند.
توجه به این نکته مهم است که این نسبت میتواند بسته به ترکیب متفاوت باشد.
برخی از هیدراتها دارای یک مولکول آب در هر واحد بیآب هستند، در حالی که برخی دیگر ممکن است چندین یا هیچ مولکول آب نداشته باشند.
درک فرمول کلی هیدرات هنگام کار با این ترکیبات ضروری است؛ زیرا اطلاعات مهمی در مورد ترکیب و ساختار آنها ارائه میدهد.
با دانستن این اطلاعات، دانشمندان میتوانند پیشبینیهای دقیقتری در مورد خواص و رفتار آنها در شرایط مختلف انجام دهند.
8# سیستم نامگذاری هیدراتها

نامگذاری ترکیبات هیدرات میتواند کمی دشوار باشد؛ اما گامی مهم در شناسایی و درک این ترکیبات شیمیایی است.
در مورد اینکه روش نامگذاری انواع هیدرات چیست، میتوان گفت: نام یک ترکیب هیدرات از دو بخش تشکیل شده است: نام ترکیب یونی و تعداد مولکولهای آب متصل به آن.
برای نامگذاری یک هیدرات، ابتدا نام ترکیب یونی را طبق معمول مینویسید.
سپس یک پیشوند اضافه میکنید که مربوط به تعداد مولکولهای آب موجود است.
به عنوان مثال، اگر سه مولکول آب در یک ترکیب یونی به نام کلرید سدیم وجود داشته باشد، فرم هیدراته آن “تری هیدرات کلرید سدیم” نامیده میشود.
شایان ذکر است که برخی از هیدراتهای رایج بر اساس کاربرد تاریخی، نامهای خاص خود را دارند.
به عنوان مثال، سولفات مس پنتاهیدرات معمولاً با نام سولفات آبی شناخته میشود.
نامگذاری هیدراتها ممکن است نیاز به حفظ کردن و تمرین داشته باشد؛ اما پس از تسلط، شناسایی آنها در تحقیقات یا مطالعات آزمایشگاهی آسانتر میشود.
9# نمونههای رایج هیدراتها چیست؟

احتمالاً شما از قبل با برخی از هیدراتها آشنا هستید؛ زیرا برخی از آنها محصولات رایج روزمره هستند؛ ولی نمونههای رایج هیدرات چیست؟
در زیر پنج نمونه از هیدراتهای رایج آورده شده است.
همه اینها هیدراتهای معدنی هستند.
1-9# نمکهای اپسوم
- نام هیدرات: سولفات منیزیم هپتاهیدرات
- کاربرد: نمک اپسوم کاربردهای متنوعی از جمله، تسکین درد عضلات، به عنوان نمک حمام، برای کاهش فشار خون سیستولیک و بهعنوان افزودنی خاک برای کمک به رشد گیاهان دارد.
2-9# سودای شستشو
- نام هیدرات: کربنات سدیم دکاهیدرات
- کاربرد: سودای شستشو نوعی صابون اولیه بود.
امروزه هنوز هم گاهی اوقات به عنوان شوینده استفاده میشود.
سودای شستشو خاصیت براقکنندگی دارد، به این معنی که در دمای اتاق برخی از مولکولهای آب خود را از دست میدهد.
3-9# بوراکس
- نام هیدرات: سدیم تترابورات دکاهیدرات
- کاربرد: بوراکس یکی از مواد تشکیل دهنده بسیاری از لوازم آرایشی، مواد شوینده، لعابهای مینای دندان و مواد ضد حریق است.
4-9# سولفات مس
- نام هیدرات: مس (II) سولفات پنتاهیدرات
- کاربرد: سولفات مس در فرم هیدرات خود به رنگ آبی روشن در میآید و به عنوان ماده رنگآمیزی در نقاشیها و سفالگری استفاده میشود.
همچنین بهعنوان قارچکش و علفکش نیز کاربرد دارد.
5-9# کلرید کبالت
- نام هیدرات: کبالت (ll) کلرید هگزاهیدرات
- کاربرد: کلرید کبالت در فرم هیدرات خود بنفش است، در حالی که فرم بیآب آن آبی روشن است.
کاغذهای پوشش داده شده با کلرید کبالت به عنوان راهی برای تشخیص رطوبت فروخته میشوند.
این کاغذها، درحالیکه در ویال خود هستند، ابتدا به رنگ آبی شروع میشوند؛ اما در صورت تشخیص رطوبت، پس از خارج شدن به رنگ صورتی در میآیند.
10# تجزیه هیدرات
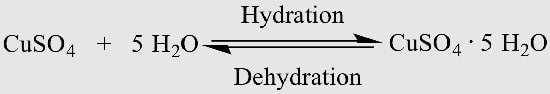
وقتی یک هیدرات گرم میشود، تجزیه میشود؛ اما فرآیند تجزیه هیدرات چیست؟
این فرایند شامل حذف مولکولهای آب از ترکیب است و میتواند منجر به تشکیل یک فرم بیآب (بدون آب) شود.
تجزیه هیدرات زمانی رخ میدهد که انرژی گرمایی برای شکستن پیوندهای بین مولکولهای آب و ترکیب اعمال شود.
حذف این مولکولهای آب میتواند باعث تغییر در رنگ، بافت و حتی خواص شیمیایی شود.
یک نمونه از این پدیده زمانی است که کریستالهای پنتاهیدرات سولفات مس آبی گرم میشوند.
با شروع تجزیه، رنگ آبی آنها محو میشود تا زمانی که تنها چیزی که باقی میماند پودر سفیدی باشد که اکنون بدون هیچ مولکول آب متصلی است.
توجه به این نکته مهم است که همه ترکیبات هیدرات ندارند یا قادر به تشکیل آنها نیستند.
با این حال، برای ترکیباتی که این خاصیت را دارند، درک چگونگی واکنش آنها در شرایط مختلف میتواند برای شیمیدانان و غیر شیمیدانان بسیار مهم باشد.
11# نکات کلیدی در مورد هیدراتها

ترکیبات یونی بدون آب (نمکها) تمایل به جذب رطوبت دارند؛ آنها بهراحتی آب را از محیط اطراف، مانند رطوبت جو، جذب میکنند.
وقتی نمکهای بیآب در آزمایشگاه باز میشوند، بلافاصله با آب جوی شروع به هیدراته شدن میکنند.
اغلب نمکهای بیآب در محیطهای خشکی که آب در آنها وجود ندارد، مانند اتمسفر خشک آرگون (Ar) نگهداری میشوند.
هنگام استفاده از نمکهای هیدراته، باید مراقب باشیم که آبهای هیدراتاسیون را هنگام محاسبه وزن فرمولی در نظر بگیریم.
به عنوان مثال، وزن فرمولی سولفات مس 159.6 (II) گرم بر مول است؛ اما وزن خشک CuSO4 · 5H2O ،249.7 گرم بر مول است.
وقتی در یک آزمایشگاه روباز با نمکهای بیآب کار میکنید، وزن فرمولی ترکیب با گذشت زمان و جذب آب تغییر میکند.
در نهایت، ممکن است فکر کنید که یک نمک بیآب، همان انحلالپذیری معادل همتای هیدراته خود را دارد؛ اما یک نمک بیآب معین میتواند انرژی شبکه بسیار بزرگی داشته باشد، انرژیای که مولکولها را در جامد کنار هم نگه میدارد.
بنابراین، ممکن است بهراحتی در آب یونیزه نشوند.
علاوه بر این، برخی از نمکهای بیآب فقط به هم چسبیده و روی آب شناور میشوند و خیلی آهسته حل میشوند.
نتیجهگیری
هیدراتها یک مفهوم مهم در شیمی هستند. آنها ترکیباتی هستند که حاوی مولکولهای آب هستند که از نظر شیمیایی به مولکولها یا یونهای دیگر متصل شدهاند.
هیدراتها به دلیل محتوای آب ساختاریافته و تأثیر آن بر خواص و کاربردهای عملیشان، از نظر شیمیایی مورد توجه زیادی هستند.
آنها میتوانند از طریق مکانیسمهای مختلفی تشکیل شوند، هنگام گرم شدن رفتارهای مشخصی از خود نشان دهند و بر اساس روش تشکیل و ویژگیهای ساختاری خود طبقهبندی میشوند.
هیدراتها کاربردهای عملی زیادی در صنایع مختلف مانند تولید مواد غذایی، داروسازی و مصالح ساختمانی دارند.
آنها همچنین میتوانند نقشهای مهمی در فرایندهای زیستمحیطی مانند هوازدگی و فرسایش ایفا کنند.
درک جامع از هیدراتها در رشتههایی مانند شیمی، علوم محیط زیست و مهندسی که در آنها معمولاً با خواص منحصربهفردشان مواجه میشوند و مورداستفاده قرار میگیرند، بسیار مهم است.
کسب دانش در مورد هیدراتها برای هر کسی که میخواهد شیمی پشت موادی را که هر روز با آنها مواجه میشویم درک کند، ضروری است.
اگر دانشجوی شیمی باشید و یا صرفاً در مورد نحوه عملکرد چیزها در سطح مولکولی کنجکاو هستید، یادگیری در مورد هیدراتها بدون شک دیدگاه شما را در مورد این حوزه جذاب علمی گسترش میدهد.
نظرتون درباره این مقاله چیه؟
ما رو راهنمایی کنید تا اون رو کامل تر کنیم و نواقصش رو رفع کنیم.
توی بخش دیدگاه ها منتظر پیشنهادهای فوق العاده شما هستیم.


