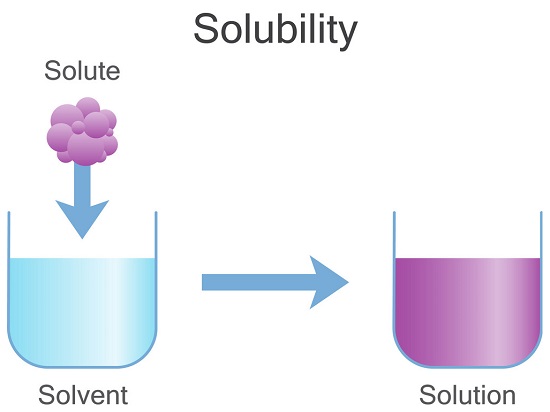
انحلال پذیری توانایی یک ماده شیمیایی جامد، مایع یا گازی (که به آن حل شونده گفته می شود) برای حل شدن در حلال (معمولاً مایع) و تشکیل محلول است.
قابلیت حل شوندگی یک ماده اساساً به حلال استفاده شده و همچنین دما و فشار بستگی دارد.
اما این تمام ماجرا نیست. برای آشنایی بیشتر با این موضوع همراه ما باشید.
1# تعریف انحلال پذیری (Solubility)
انحلال پذیری به عنوان حداکثر مقداری از ماده که می تواند در ماده دیگر حل شود، تعریف می شود.
این حداکثر مقدار از حل شونده است که می تواند در حالت تعادل در یک حلال حل شده و منجر به تولید محلول اشباع شود.
در محلول اشباع، افزودن حل شونده بیشتر باعث افزایش غلظت محلول نشده و
در عوض، حل شونده اضافی رسوب می کند؛
یعنی بعد از رسیدن به حالت اشباع هر چه حل شونده بیشتری به محلول اضافه کنیم رسوب بیشتری تولید می شود.
2# تفاوت انحلال پذیری و امتزاج پذیری (solubility and miscibility)
در مورد حل شدن مایعات در یکدیگر ممکن است واژه امتزاج پذیری نیز مطرح شود که
این سوال را برای شما به وجود می آورد که تفاوت امتزاج پذیری و انحلال پذیری چیست؟
اگر ماده ای در یک حلال خاص با تمام نسبت ها محلول باشد، به آن ماده امتزاج پذیر گفته می شود که
این خاصیت امتزاج پذیری نامیده می شود.
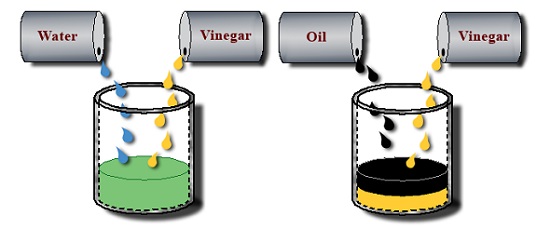
به عنوان مثال، سرکه و آب با هر نسبتی کاملاً در یکدیگر مخلوط شده و امتزاج پذیر هستند.
از طرف دیگر، روغن و سرکه با هم مخلوط نشده و امتزاج ناپذیر هستند.
در صورتی که روغن و سرکه مقدار جزئی در یکدیگر حل شده و تا حدودی انحلال پذیر هستند.
3# عوامل موثر بر انحلال پذیری
انحلال پذیری به عوامل زیر بستگی دارد که در ادامه یک به یک آن ها را شرح می دهیم:

- دما
- قطبیت
- فشار
- اندازه مولکولی
- هم زدن
- مقدار ماده حل شونده
1-3# دما (Temperature)
اصولاً انحلال پذیری با دما افزایش می یابد. این مورد در مورد بیشتر حلال ها صدق می کند.
اما اوضاع برای گازها متفاوت است.
با افزایش دما قابلیت حل شوندگی آن ها در یکدیگر و در آب کمتر شده؛ اما در حلال های آلی انحلال پذیرتر می شوند.
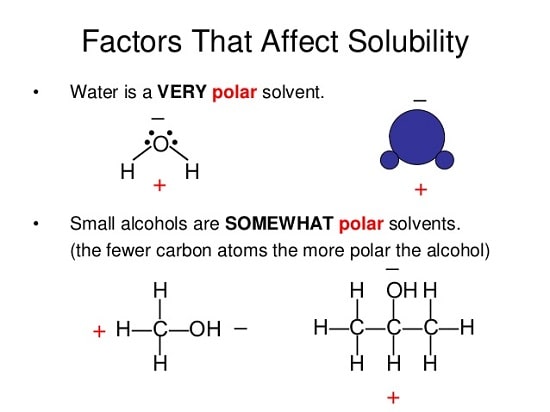
2-3# اثر قطبیت بر انحلال پذیری (polarity)
در بیشتر موارد حل شونده ها در حلال هایی حل می شوند که دارای قطبیت مشابه هستند.
بدین معنی که حل شونده های قطبی در حلال های قطبی حل می شوند و برعکس.
همچنین حل شونده غیر قطبی در حلال های قطبی حل نشده و برعکس.
به عنوان مثال آب که یک مولکول قطبی است در نفت که یک مولکول غیر قطبی است حل نمی شود.
3-3# فشار (Pressure)
برای بیشتر حل شونده های جامد و مایع، فشار بر قابلیت حل شوندگی آن ها تأثیری ندارد.
برای حل شونده های گازی، افزایش فشار باعث افزایش انحلال پذیری و کاهش فشار باعث کاهش انحلال پذیری می شود.
برای مثال وقتی درب بطری نوشابه را باز می کنید، فشار کم شده و
حباب های گاز حل شونده از محلول خارج می شود.

4-3# اثر اندازه مولکولی بر انحلال پذیری (Molecular size)
هرچه مولکول های حل شونده ها بزرگتر باشند، وزن مولکولی و اندازه آن ها بزرگتر شده و
احاطه مولکول های بزرگتر توسط مولکول های حلال دشوارتر می شود.
اگر همه عوامل ذکر شده فوق حذف شوند، می توان یک قانون کلی را پیدا کرد که
ذرات بزرگتر به طور کلی کمتر انحلال پذیر هستند.
اگر فشار و دمای دو حل شونده قطبی یکسان باشد،
ماده ای که اندازه مولکولی کوچکتری دارد معمولاً انحلال پذیرتر است.

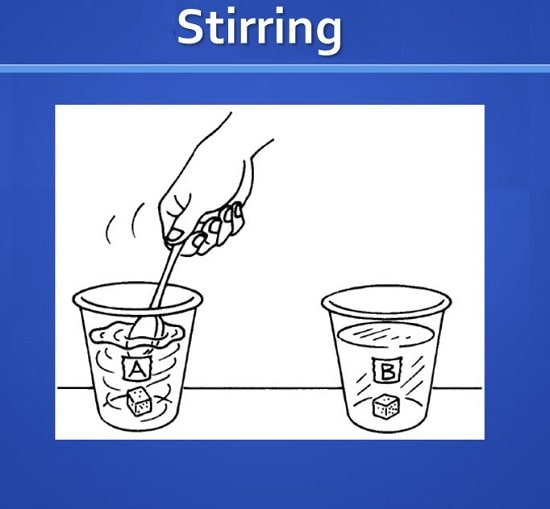
5-3# هم زدن (Stirring)
هم زدن تأثیری در حل شوندگی ماده ندارد؛
اما همه می دانند که اگر قند را در چای خود انداخته و هم نزنید، حل نمی شود.
در واقع، اگر قند را برای مدت زمان کافی (طولانی تر) بگذاریم تا در چای بماند، حل می شود.
هم زدن فقط سرعت حل شدن را افزایش می دهد.
هم زدن باعث افزایش حرکت حلال شده و ماده حل شونده را در قسمت های تازه آن قرار می دهد.
در نتیجه قابلیت حل شدن را فراهم می کند.
از آن جا که مولکول های موجود در مواد مایع به طور مداوم در حال حرکت هستند،
به هر حال انحلال پذیری انجام می شود؛ اما زمان بیشتری طول می کشد.
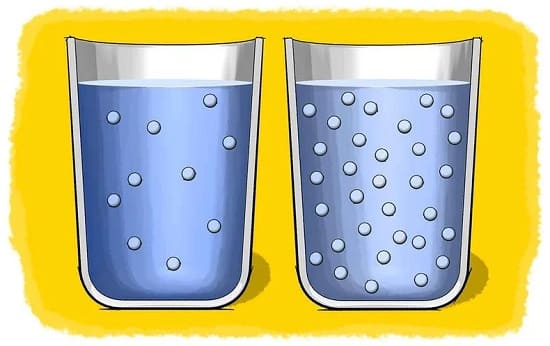
6-3# مقدار ماده حل شونده (Amount of solute)
هنگامی که مقدار کمی حل شونده را در حلال بریزید، حل شوندگی به سرعت انجام می شود و
در مقابل وقتی مقدار زیادی از حل شونده را در حلال بریزید، انحلال پذیری با سرعت کمتری انجام می شود.
در واقع مقدار حل شونده به شرطی که از میزان محلول اشباع تجاوز نکند، تأثیری در حل شوندگی ماده ندارد و
همانند هم زدن در زمان حل شدن آن موثر است؛ اما همان طور که در مفهوم انحلال پذیری اشاره شد،
در صورتی که میزان آن از محلول اشباع تجاوز کند، موجب تشکیل رسوب می گردد.
 |
نظرتون درباره این مقاله چیه؟
ما رو راهنمایی کنید تا اون رو کامل تر کنیم و نواقصش رو رفع کنیم.
توی بخش دیدگاه ها منتظر پیشنهادهای فوق العاده شما هستیم.



ممنون بابت مطالب ارائه شده
سلام دوست عزیز
سپاس از شما بابت لطف تون
همواره موفق باشید