محلولها که به عنوان مخلوطهای همگن تعریف میشوند، آنقدر کاملاً با هم مخلوط شدهاند که هیچ یک از اجزای آنها را نمیتوان مستقل از دیگری مشاهده کرد.
محلولها بخش بزرگی از زندگی روزمره هستند و بسیاری از واکنشهای شیمیایی اطراف ما در محلول اتفاق میافتد.
در واقع، بسیاری از واکنشهای شیمیایی که در بدن ما نیز رخ میدهد، در محلول اتفاق میافتد.
بسیاری از آنچه که مینوشیم به عنوان مثال، نوشابه، قهوه، چای و شیر محلول هستند، در حالی که برای این مصارف فرایند محلول سازی صورت گرفته است؛ ولی محلول سازی چیست؟
به طور کلی محلول سازی یک تکنیک اساسی و حیاتی در شیمی تجزیه، به ویژه برای آنالیز کروماتوگرافی، آنالیز کمی و سایر آزمایشهای دقیق است.
در تحقیقات علمی و در کنترل کیفیت معمول، دقت محلولها مستقیماً بر قابلیت اطمینان نتایج تأثیر میگذارد.
در این مقاله به تعریف محلول و انواع آن پرداخته و به این سؤال که محلول سازی چیست، پاسخ خواهیم داد.
1# محلول چیست؟

محلول، مخلوطی است که از حل کردن یک یا چند ماده در یک مایع ساخته میشود.
جز اصلی محلول، حلال و جز های فرعی، حلشونده نامیده میشوند.
اگر هر دو جز در یک محلول ۵۰٪ باشند، میتوان اصطلاح حلشونده را به هر یک از اجزا نسبت داد.
وقتی یک ماده گازی یا جامد در یک مایع حل میشود، گاز یا ماده جامد، حلشونده نامیده میشود.
وقتی دو مایع در یکدیگر حل میشوند، جز اصلی، حلال و جز فرعی، حلشونده نامیده میشود.
بسیاری از واکنشهای شیمیایی در محلولها انجام میشوند و محلولها نیز ارتباط نزدیکی با زندگی روزمره ما دارند.
هوایی که تنفس میکنیم، مایعاتی که مینوشیم و مایعات موجود در بدن ما، همگی محلول هستند.
محلولها باید همگن باشند.
همگن به معنی «در تمام قسمتها یکسان» است.
مثلاً در لیموناد، انتظار ندارید که یک لیوان لیموناد با هر جرعه طعم متفاوتی داشته باشد.
یک جرعه نباید شیرینتر یا ترشتر از جرعه بعدی باشد.
در عوض، هر جرعه باید طعم یکسانی داشته باشد.
برای اینکه این موضوع درست باشد، مواد حلشونده باید حل شوند و کاملاً با حلال مخلوط شوند.
مخلوطی از شن و آب محلول نیست؛ زیرا شن در آب حل نمیشود.
2# محلول سازی چیست؟

در پاسخ به این سؤال که محلول سازی چیست، میتوان اینگونه بیان کرد که محلولسازی (Solution Preparation) به فرایند تهیه دقیق یک مخلوط همگن از یک یا چند ماده (حلشونده) در یک حلال (معمولاً آب) با غلظت مشخص گفته میشود.
این کار پایهایترین و حیاتیترین مهارت در آزمایشگاههای شیمی، زیستشناسی، پزشکی، داروسازی و صنایع است.
باتوجه به این که مواد در سه حالت جامد، مایع و گاز وجود دارند.
فرایند محلول سازی نیز در تمام این حالتها انجام میگیرد؛ اما اینکه در این مدلها شرایط محلول سازی چیست، موارد زیر قابلذکر میباشد:
- مخلوطهای گازی معمولاً همگن هستند و معمولاً محلولهای گاز – گاز هستند.
جو یک محلول گازی است که از نیتروژن، اکسیژن، آرگون، دیاکسیدکربن، آب، متان و برخی اجزای جزئی دیگر تشکیل شده است.
غلظت برخی از این اجزا، مانند آب، اکسیژن و دیاکسیدکربن، ممکن است در مکانهای مختلف زمین بسته به عواملی مانند دما و ارتفاع متفاوت باشد. - وقتی مولکولهای گاز، جامد یا مایع پراکنده و با مولکولهای مایع مخلوط میشوند، حالتهای همگن (یکنواخت) محلولهای مایع نامیده میشوند.
جامدات، مایعات و گازها در یک حلال مایع حل میشوند و محلولهای مایع تشکیل میدهند. - بسیاری از آلیاژها، سرامیکها و مخلوطهای پلیمری محلولهای جامد هستند.
در یک محدوده خاص، مس و روی در یکدیگر حل میشوند و سخت میشوند تا محلولهای جامدی به نام برنج ایجاد کنند.
نقره، طلا و مس آلیاژهای مختلف زیادی با رنگها و ظاهرهای منحصربهفرد تشکیل میدهند.
آلیاژها و سایر محلولهای جامد در دنیای شیمی مواد مهم هستند.
3# انواع محلولها

اصولاً انواع محلولها بر اساس معیار انحلالپذیری به سه دسته تقسیم میشوند؛ اما انحلالپذیری در محلول سازی چیست؟
حداکثر مقدار مادهای که میتواند در حجم معینی از حلال حل شود، انحلالپذیری نامیده میشود.
اغلب، انحلالپذیری در آب بر حسب گرم در ۱۰۰ میلیلیتر بیان میشود.
این سه دسته عبارتاند از:
- محلولی که به حداکثر انحلالپذیری خود نرسیده باشد، محلول غیراشباع نامیده میشود.
این بدان معناست که هنوز میتوان حلشونده بیشتری به حلال اضافه کرد و حلشدن همچنان رخ میدهد. - محلولی که به حداکثر حلالیت رسیده است، محلول اشباع نامیده میشود.
اگر در این مرحله حلشونده بیشتری اضافه شود، در محلول حل نمیشود.
در عوض، به صورت جامد در ته محلول رسوب میکند؛ بنابراین، اغلب میتوان گفت که اگر حلشونده اضافی وجود داشته باشد، محلول اشباع شده است.
در یک محلول اشباع، هیچ تغییر خالصی در مقدار حلشونده، حلشده وجود ندارد؛ اما سیستم به هیچ وجه ایستا نیست. - در شرایط خاص، یک محلول ممکن است فوق اشباع باشد.
محلولهای فوق اشباع، محلولهایی هستند که حلشونده را فراتر از نقطه اشباع طبیعی در خود حل کردهاند.
معمولاً برای ایجاد یک محلول فوق اشباع، شرایطی مانند افزایش دما یا فشار لازم است.
4# روشهای محلول سازی
در این قسمت موضوع بحث این است که روشهای محلول سازی چیست؟
در حالت کلی برای انجام محلولسازی دو روش کلی مطرح است.
این دو روش عبارتاند از:
1-4# محلول سازی از جامدات

در این حالت محلولسازی با وزنکردن مقدار مناسبی از یک جامد خالص قراردادن آن در یک بالن مناسب و رقیق کردن تا حجم مشخص تهیه میشود.
اینکه دقیقاً یک معرف چگونه اندازهگیری میشود، به واحد غلظت موردنظر بستگی دارد.
به عنوان مثال، برای تهیه محلولی با غلظت مشخص، مقدار مناسبی از معرف را وزن میکنید، آن را در مقداری از حلال حل میکنید و به حجم موردنظر میرسانید و برای تهیه محلولی که غلظت حلشونده در آن درصد حجمی است، مقدار مناسبی از حلشونده را اندازهگیری کرده و حلال کافی را برای بهدستآوردن حجم کل موردنظر اضافه میکنید.
2-4# محلولسازی از مایعات

این نوع از محلولسازی که تحت عنوان رقیقسازی نیز یاد میشود، با رقیق کردن حجم کمی از یک محلول غلیظتر با حلال اضافی، محلولی با غلظت دلخواه تهیه کرد.
محلول مادر که محلولی آماده با غلظت مشخص است، اغلب برای این منظور استفاده میشود.
هنگام تهیه محلولهایی با غلظت بسیار ضعیف رقیق کردن محلول مادر ترجیح داده میشود؛ زیرا روش جایگزین، یعنی وزنکردن مقادیر بسیار کم حلشونده، میتواند بادقت بالایی دشوار باشد.
رقیقسازی همچنین برای تهیه محلولهایی از موادی که به عنوان محلولهای آبی غلیظ فروخته میشوند، مانند اسیدهای قوی، استفاده میشود.
این روش مستلزم محاسبه مقدار حلشونده موردنظر در حجم نهایی محلول رقیقتر و سپس محاسبه حجم محلول پایهای است که حاوی این مقدار حلشونده است.
به یاد داشته باشید که رقیق کردن مقدار معینی از محلول پایه با حلال، مقدار حلشونده موجود را تغییر نمیدهد، فقط حجم محلول تغییر میکند؛ بنابراین، رابطه بین حجم و غلظت محلول پایه و حجم و غلظت محلول رقیقشده موردنظر را میتوان به صورت ریاضی بهصورت زیر بیان کرد:
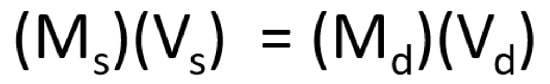
که در آن M s غلظت محلول مادر، V s حجم محلول مادر، M d غلظت محلول رقیق شده و V d حجم محلول رقیق شده است.
5# تجهیزات موردنیاز برای محلول سازی

محلول سازی به دلیل اهمیتی که دارد نیاز به تجهیزات دقیق دارد.
این موضوع که لیست ابزارهای ضروری و نقش آنها در محلول سازی چیست، در ادامه آمده است:
- بالن حجمی: این ابزار اصلی برای تهیه محلولهای استاندارد است.
از آن برای رقیق کردن یک ماده تا حجم مشخص استفاده میشود و اندازهگیری دقیق غلظت محلول را تضمین میکند. - ترازوی تحلیلی: از ترازوی تحلیلی برای وزنکردن مادهای که قرار است در بالن حجمی حل شود استفاده میشود.
اندازهگیری ماده بادقت بالا، بسیار مهم است. - پیپت و بورت: برای تیتراسیون و اندازهگیری دقیق حجم محلولها، از پیپت و بورت استفاده میشود.
- بشرها و میلههای همزن: بشرها برای حلکردن ماده در حلال استفاده میشوند، در حالی که میلههای همزن به حلشدن یکنواخت ماده کمک میکنند.
- آب مقطر: آب مقطر بهعنوان حلال برای تهیه محلولها استفاده میشود؛ زیرا عاری از ناخالصیهایی است که میتوانند در واکنش اختلال ایجاد کنند.
6# مراحل محلول سازی

با توجه به این که نوع محلول سازی چیست، ممکن است مراحل محلولسازی متفاوت باشد؛ ولی به طور کلی برای تهیه یک محلول 7 مرحله وجود دارد که به شرح زیر میباشد:
1-6# غلظت محلول را تعیین کنید.
غلظت، میزان ماده حلشونده در محلول را توصیف میکند.
برای مثال، یک محلول نمکی با وزن 10٪ حجمی، حاوی 10 گرم نمک در 100 میلیلیتر آب است.
روشهای زیادی برای بیان غلظت یک محلول وجود دارد.
بسیاری از آزمایشهای علمی به غلظت خاصی از محلول نیاز دارند.
اگر روش آزمایشی خود را انجام میدهید، باید بر اساس تحقیقات پیشین خود، غلظت را خودتان تعیین کنید.
2-6# حلشونده و حلال موردنیاز را محاسبه کنید.
وقتی غلظت موردنظر محلول و مقدار محلول موردنیاز را دانستید، میتوانید مقدار حلشونده و حلال موردنیاز را محاسبه کنید.
برای کمک به محاسبات ریاضی، به بخش نحوه محاسبه غلظت محلولها مراجعه کنید.
3-6# اقدامات احتیاطی ایمنی را رعایت کنید.
اگر از مواد خطرناک استفاده میکنید یا نیاز دارید که محلولهای خود را استریل (عاری از میکروب) نگه دارید، ممکن است لازم باشد از برخی تجهیزات ایمنی استفاده کنید.
4-6# ماده حلشونده را وزن یا اندازهگیری کنید.
اگر ماده حلشونده جامد است، از ترازو برای وزنکردن مقدار صحیح استفاده کنید.
برای دقت بیشتر، از ترازویی استفاده کنید که حداقل یکدهم گرم را اندازهگیری کند.
اگر ماده حلشونده مایع است، از پیمانه، استوانه مدرج یا پیپت برای اندازهگیری مقدار صحیح استفاده کنید.
این که از کدام یک استفاده کنید به نوع پروژه علمی بستگی دارد.
یک پروژه علمی آشپزی ممکن است از پیمانه استفاده کند.
یک پروژه شیمی احتمالاً برای دقت بیشتر از استوانه مدرج یا پیپت استفاده میکند.
5-6# حلشونده را حل کنید.
برای دقت بیشتر، حلشونده را در یک استوانه مدرج یا ظرف اندازهگیری بهاندازه کافی بزرگ بریزید تا تمام محلول را در خود جای دهد.
کمی از مقدار کل حلال اضافه کنید.
حلال و حلشونده را مخلوط کنید تا حلشونده کاملاً حل شود.
حلال بیشتری اضافه کنید تا محلول به حجم دلخواه برسد. دوباره مخلوط کنید.
6-6# بررسیهای ایمنی و کیفیت را انجام دهید.
گاهی اوقات یک محلول باید خواص خاصی داشته باشد.
در صورت لزوم pH، رسانایی یا سایر خواص محلول خود را بررسی کنید.
بر اساس نتایج، خواص محلول خود را در صورت نیاز تنظیم کنید.
7-6# محلول را برچسب گذاری کرده و نگهداری کنید
در صورت نیاز، محلول خود را به یک ظرف نگهداری منتقل کنید.
بلافاصله ظرف را با نام محلول، غلظت و تاریخ ساخت آن برچسبگذاری کنید.
7# غلظت محلول
در شیمی، غلظت بهعنوان فراوانی یک جز تشکیلدهنده تقسیم بر حجم کل مخلوط تعریف میشود؛ اما مفهوم غلظت در محلول سازی چیست؟
همه ما یک ایده کیفی از مفهوم غلظت داریم.
هر کسی که قهوه فوری یا لیموناد درست کرده باشد، میداند که پودر زیاد، نوشیدنی با طعم قوی و غلظت بالا تولید میکند، در حالی که پودر خیلی کم، محلول رقیقی ایجاد میکند که تشخیص آن از آب دشوار است.
از نظر کمی، غلظت یک محلول، مقدار حلشوندهای را که در مقدار خاصی از آن محلول وجود دارد، توصیف میکند.
دانستن غلظت حلشوندهها در کنترل استوکیومتری واکنشدهندهها برای واکنشهایی که در محلول رخ میدهند، مهم است و برای بسیاری از جنبههای زندگی ما، از اندازهگیری دوز صحیح دارو گرفته تا تشخیص آلایندههای شیمیایی مانند سرب و آرسنیک، حیاتی است.
رایجترین روشهای ارائه غلظت محلول عبارتاند از: مولاریته و تعداد اجزا در هر محلول.
1-7# مولاریته
رایجترین واحد غلظت، مولاریته است که برای محاسبات مربوط به استوکیومتری واکنشها در محلول نیز مفیدترین واحد است.
مولاریته (M) یک محلول، تعداد مولهای حلشونده موجود در دقیقاً ۱ لیتر محلول است.
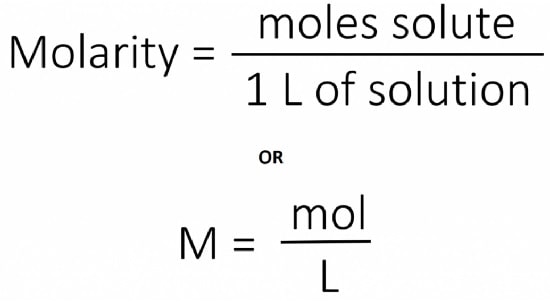
بنابراین، واحدهای مولاریته، مول در هر لیتر محلول (mol/L) هستند که به اختصار M نشان داده میشوند.
2-7# قطعات در محلول
در دنیای مصرفکنندگان و صنعت، رایجترین روش بیان غلظت، بر اساس مقدار ماده حلشونده در مقدار ثابتی از محلول است.
«مقادیر» مورد اشاره در اینجا میتوانند بر حسب جرم، حجم یا هر دو (یعنی جرم ماده حلشونده در حجم معینی از محلول) بیان شوند.
برای تمایز بین این احتمالات، از اختصارات (m/m)، (v/v) و (m/v) استفاده میشود.
8# کاربردهای محلول سازی

محلولهای پایه، که بهعنوان محلولهای استاندارد نیز شناخته میشوند، نقش حیاتی در صنایع مختلف ایفا میکنند و روشی مناسب و کارآمد برای اطمینان از اندازهگیریهای دقیق و مداوم در کاربردهای مختلف ارائه میدهند.
این محلولها که با حل کردن مقدار دقیقی از یک ماده در حجم مشخصی از حلال تهیه میشوند، کاربردهای عملی در طیف وسیعی از زمینهها، از داروسازی گرفته تا تولید مواد غذایی و آشامیدنی، دارند.
بررسی این که در این زمینهها کاربرد محلول سازی چیست، به صورت زیر میباشد:
- در صنعت داروسازی، محلول سازی معمولاً برای فرمولاسیون دارو و اهداف کنترل کیفیت استفاده میشوند.
شرکتهای داروسازی برای اطمینان از اثربخشی و ایمنی محصولات خود به غلظتهای دقیق و استاندارد مواد مؤثر متکی هستند. - صنعت دیگری که به شدت به محلول سازی متکی است، بخش محیط زیست است.
دانشمندان و محققان محیط زیست اغلب از محلولهای استاندارد برای تجزیه و تحلیل نمونههای آب و خاک برای آلایندهها و آلایندهها استفاده میکنند. - صنعت غذا و نوشیدنی نیز از کاربرد محلول سازی میبرد.
به عنوان مثال، تولیدکنندگان مواد غذایی از محلولهای پایه برای تعیین محتوای تغذیهای محصولات خود استفاده میکنند.
9# موارد ایمنی در محلول سازی

مواد شیمیایی مورد استفاده در آزمایشگاهها میتوانند سمی، قابل اشتعال، خورنده و مجموعهای از خطرات دیگر باشند.
جابجایی ایمن مواد شیمیایی بخش مهمی از تضمین سلامت و ایمنی کسانی است که با آنها کار میکنند.
همچنین در هزینههای دفع و تولید صرفهجویی میکند و برای محیط زیست سالمتر است.
هنگام کار با مواد شیمیایی، همیشه مهم است که بدانید با چه خواصی کار میکنید و چه خطراتی میتواند با آنها مرتبط باشد.
در مورد این که برخی از ملاحظات ایمنی در محلول سازی چیست، میتوان به موارد زیر اشاره کرد:
- هنگام کار با مواد شیمیایی و تهیه محلولها، همیشه از تجهیزات حفاظت فردی (PPE) مناسب استفاده کنید.
- برای دور نگه داشتن میکروبها از دستهایتان و تماس آنها با محلولها و اکثر مواد شیمیایی از پوستتان از دستکش استفاده نمایید.
اگر از مواد شیمیایی قوی مانند اسید یا باز بسیار قوی استفاده میکنید، ممکن است نیاز به استفاده از دستکشهای مقاوم در برابر مواد شیمیایی داشته باشید.
این دستکشها برای اکثر پروژههای علمی رایج نیستند. - برای جلوگیری از ورود مواد شیمیایی به چشم عینک یا گان مخصوص پاشش مواد شیمیایی استفاده کنید.
- اگر مواد شیمیایی مورد استفاده شما ممکن است چشمهایتان را تحریک کند، استفاده از این عینکها ایده خوبی است.
- قبل از استفاده، برچسب مواد شیمیایی را دو بار بخوانید.
- هنگام استفاده از مواد شیمیایی غلیظ برای تهیه محلول، حتماً محلول غلیظتر را به آرامی به محلول کمغلظتتر اضافه کنید.
- مزایای شبیهسازی آزمایشگاه مجازی را برجسته کنید.
آزمایشگاه مجازی مشکلات آزمایش در دنیای واقعی را ندارد. - بسته بندی نتایج حاصل را به دقت انجام دهید.
سخن آخر
محلول سازی یک فرایند اساسی در شیمی است که نقش حیاتی در تجزیه و تحلیل کمی ایفا میکند.
محلول سازی تهیه محلولهایی با غلظت مشخص هستند و تهیه دقیق آنها برای انجام تیتراسیونها، کالیبراسیونها و سایر روشهای تحلیلی قابل اعتماد ضروری است.
این محلولها به دست آمده در کاربردهای مختلف در آزمایشگاهها، تحقیقات و صنایع، مانند داروسازی، آزمایشهای زیستمحیطی و ایمنی مواد غذایی، نقش محوری دارند.
رعایت نکات ایمنی، نگهداری و جابجایی صحیح محلولها برای جلوگیری از آسیب در حین کار، حفظ اثربخشی آنها و جلوگیری از آلودگی بسیار مهم است.
به یاد داشته باشید، کلید موفقیت در محلول سازی، ذخیره، محاسبات دقیق، اندازهگیریهای دقیق و برچسبگذاری و ذخیرهسازی مناسب است.
نظرتون درباره این مقاله چیه؟
ما رو راهنمایی کنید تا اون رو کامل تر کنیم و نواقصش رو رفع کنیم.
توی بخش دیدگاه ها منتظر پیشنهادهای فوق العاده شما هستیم.


