احتمالا شما هم شنیده اید که انرژی درونی به انرژی ذرات سازنده مواد و به عنوان انرژی مرتبط با حرکت تصادفی و بی نظم مولکول ها گفته می شود.
اما آیا درباره ویژگی های این انرژی در هر ماده ای اطلاعات دارید؟
در این مقاله سعی داریم به زبان ساده درباره انرژی درونی هر جسم صحبت کنیم.

1# انرژی درونی چیست؟
این مقیاس از انرژی مرتبط با اجسام متحرک متفاوت است.
انرژی دورنی به انرژی میکروسکوپی نامرئی در مقیاس اتمی و مولکولی اشاره دارد.
به عنوان مثال، یک لیوان آب که در دمای اتاق روی یک میز گذاشته شده است، هیچ انرژی ظاهری، بالقوه یا جنبشی ندارد.
اما در مقیاس میکروسکوپی توده ای از مولکول های پر سرعت است که
با سرعت صدها متر در ثانیه حرکت می کنند.
همچنین اگر آب در داخل اتاق ریخته شود، این انرژی میکروسکوپی لزوما تغییر نمی یابد.
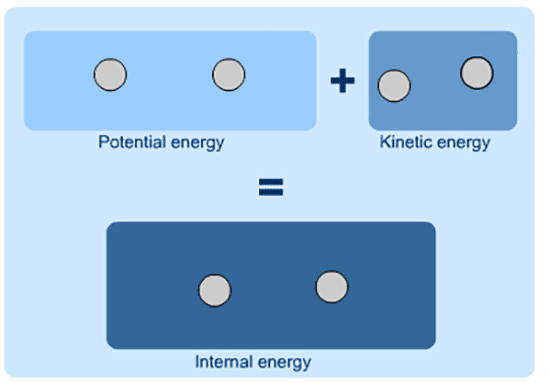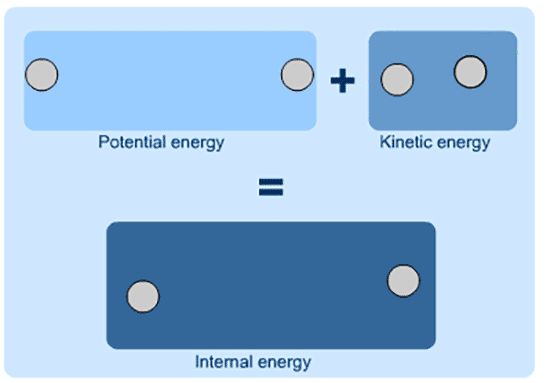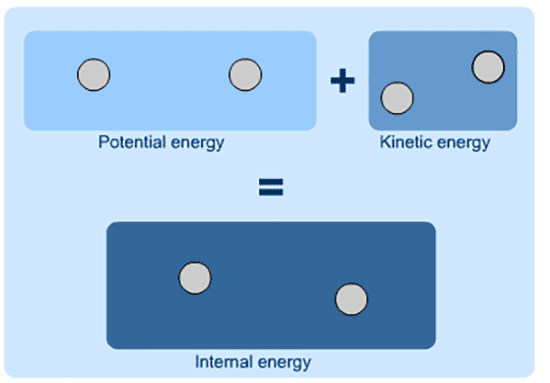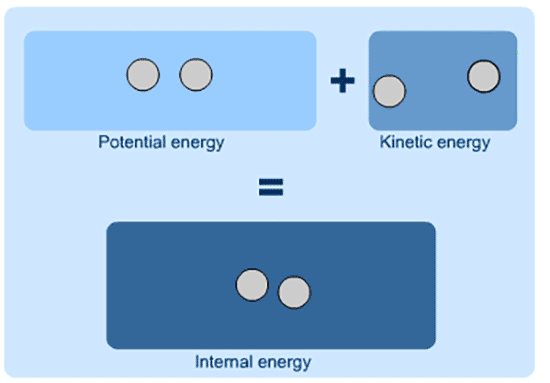
در شیمی و فیزیک، انرژی درونی (U) به عنوان کل انرژی یک سیستم بسته تعریف می شود.
انرژی درونی مجموع انرژی بالقوه و انرژی جنبشی سیستم است.
2# تاریخچه انرژی درونی (Internal Energy)
جیمز ژول رابطه گرما، کار و دما را مورد مطالعه قرار داد. وی مشاهده کرد که
اصطکاک در یک مایع (مانند تحریک آن توسط یک چرخ دستی) باعث افزایش درجه حرارت آن می شود.
وی از این اتفاق به عنوان تولید مقداری گرما نام برد.
3# نحوه اندازه گیری انرژی درونی
این کمیت یک خاصیت گسترده است.
یعنی مقدار آن به مقدار یک ماده در یک حالت معین بستگی دارد.
در عمل، مقدار مطلق انرژی داخلی (U) مشخص نیست و
نمی توان آن را اندازه گیری کرد.
زیرا تعیین دقیق بیشتر مقادیر بسیار دشوار است.
در اندازه گیری این انرژی معمولا به جای بیان مقدار مطلق، با استناد به برخی از حالت های استاندارد آن را محاسبه می کنند.
4# نحوه تغییر انرژی درونی
برخلاف گازها در سیستم های بسته که
امکان انتقال ماده نداریم تغییرات در انرژی داخلی توسط اعمال انرژی انجام می شود.
انرژی درونی یک ماده ممکن است با اعمال اقداماتی چون حرارت دهی، اعمال فشار، میدان الکتریکی، میدان مغناطیسی و غیره تغییر پیدا کند.
به عنوان مثال با استفاده از انرژی حرارتی می توان انرژی درونی آب را افزایش داد و
یا با انتقال انرژی الکتریکی به سیم مسی انرژی داخلی آن را تغییر داد.
5# نمونه ای از انرژی داخلی
زمانی که با چکش روی جسمی کوبیده شود یا
جسمی روی زمین کشیده شود، پس از مدتی با لمس کردن آن جسم متوجه تغییر دما در آن می شوید.
این بارز ترین نمونه از انرژی درونی یک جسم است.
در این مثال ایجاد اصطکاک سبب افزایش انرژی داخلی و تولید گرما می شود؛ اما میزان تغییرات در انرژی درونی در اجسام مختلف متفاوت خواهد بود.
هنگامی که یک میزان از آب و مس هر دو با 1 درجه سانتیگراد گرم می شوند، انرژی اعمال شده یکسان است.
به عنوان مثال برای دستیابی به افزایش یکسان انرژی در آب باید
میزان بسیار بیشتری از انرژی به بخش انرژی بالقوه انرژی داخلی اضافه شود.
بنابراین کل انرژی مورد نیاز برای افزایش دمای آب بسیار بیشتر است.
این به دلیل تفاوت در انرژی درونی اجسام مختلف است.
6# بخش های مختلف در انرژی درونی
1-6# انرژی جنبشی یا حرارتی
انرژی ای که جسم به دلیل حرکات مولکولی درون خود دارد به عنوان انرژی حرارتی نامیده می شود.
از آن جا که انرژی حرارتی به درجه حرارت بستگی دارد به آن انرژی گرمایی نیز گفته می شود.
انرژی حرارتی مستقیماً متناسب با دما است که شامل سه نوع از انرژی می شود:
- انرژی انتقالی (Etrans)
انرژی مرتبط با مولکول ها به دلیل حرکت مداوم، سریع و تصادفی در طول مسیر مستقیم، انرژی Translational نامیده می شود.
مولکول های گازها یا مایعات در حالت حرکت تصادفی ثابت قرار دارند.
از این رو مولکول های گازها و مایعات دارای انرژی Translational هستند.
- انرژی ارتعاشی (Evibr)
انرژی مرتبط با ارتعاشات اتمی مولکول ها، انرژی ارتعاش نامیده می شود.
یک نیروی دفع کننده بین هسته های دو اتم و الکترون های دو اتم وجود دارد.
همچنین بین هسته یک اتم و الکترون های دیگر اتم ها یک نیروی جذب کننده وجود دارد و برعکس.
در نتیجه این جاذبه ها و دافعه ها، اتم ها در حال حرکت و ارتعاش هستند.
- انرژی چرخشی (Erot)
انرژی مرتبط با چرخش مولکول ها به عنوان انرژی چرخشی نامیده می شود.
تمام مولکول های دیاتومیک و پلیاتومیک در حول یک محور عمود بر مولکول می چرخند.
بنابراین کل انرژی جنبشی سیستم به وسیله این بخش ها در فرمول K.E. = Etrans + Evibr + Erot داده می شود.
2-6# انرژی پتانسیل یا پیوند دهنده
دومین بخش انرژی درونی که به بررسی آن می پردازیم، انرژی پتانسیل یا پیوند دهنده می باشد.
انرژی نهفته یک جسم که ممکن است به انرژی حرارتی یا جنبشی تبدیل شود انرژی پتانسیل نام دارد.
انرژی پتانسیل مستقل از دما است و به دلیل پیوند بین اتم ها در یک مولکول به وجود می آید.
این انرژی به دو نوع طبقه بندی می شود:
- انرژی بین مولکولی (Eintermole)
به مقدار انرژی لازم برای جدا کردن مولکول ها از یکدیگر، انرژی بین مولکولی گفته می شود.
در مواد نیمه جامد و مایعات، مولکول ها با استفاده از نیروهای بدنی ضعیف از جاذبه به نام نیروهای واندروال در کنار هم قرار می گیرند.
این نیروها در مواد جامد قوی هستند از این رو انرژی بین مولکولی بیشتر از مایعات در مواد جامد است.
- انرژی درون مولکولی (Eintramole)
انرژی لازم برای شکستن مولکول در اتم های تشکیل دهنده آن به عنوان انرژی درون مولکولی نامیده می شود.
اتم ها توسط نیروی الکترواستاتیک خاصی از جاذبه به نام پیوند شیمیایی در مولکول نگه داشته می شوند.
بنابراین انرژی درون مولکولی چیزی نیست جز
انرژی مورد نیاز برای شکستن پیوندهای شیمیایی برای جدا کردن اتم های تشکیل دهنده آن از یکدیگر.
بنابراین کل انرژی بالقوه سیستم توسط این بخش ها در فرمول P.E. = Eintermole + Eintramole داده می شود.
7# کل انرژی داخلی یک سیستم
انرژی درونی مجموع K.E و P.E است و نمی توان ارزش مطلق آن را تعیین کرد.
اگرچه تغییر در آن تاثیرگذار است.
تغییرات در انرژی درونی برابر است با
گرمای اضافه شده به سیستم به اضافه کارهایی که توسط سیستم انجام می شود. یعنی:
ΔU = Q +W
8# ویژگی های انرژی درونی
- به مقدار ماده بستگی دارد، از این رو خاصیت گسترده ای است.
- نشان دهنده تغییر در آن معمولا نمو کردن گرما در یک واکنش در دمای ثابت و حجم ثابت است.
- در فرآیند ایزوترمال تغییر در آن صفر است.
- این یک ویژگی ثابت در جسم است. تغییری که در انرژی درونی انجام می شود مستقل از مسیری است که دنبال می شود.
- تغییر در انرژی درونی در یک فرآیند چرخه ای برابر با صفر است.
نظرتون درباره این مقاله چیه؟
ما رو راهنمایی کنید تا اون رو کامل تر کنیم و نواقصش رو رفع کنیم.
توی بخش دیدگاه ها منتظر پیشنهادهای فوق العاده شما هستیم.




اطلاعات خوبی رو گفته بودید👍
سلام همراه محترم
از محبتی که به ما دارید ممنونیم
موفق باشید