دانشمندان در ابتدا اتم را کوچکترین جزء ممکن ماده می دانستند؛
اما بعدها مشخص شد اتم ها خود نیز از ذرات کوچکتری تشکیل شده اند که
دارای جرم و بار هستند و ساختار اتم را شکل می دهند.
شاید در اولین نگاه برای شما هم عجیب باشد ذره ای که با چشم دیده نمی شود چطور در داخلش ذرات دیگری وجود دارد.
اما این تمام ماجرا نیست. برای آشنایی بیشتر با ساختار اتم با ما همراه باشید.
1# ساختار اتم (Structure of Atom)
اتم کوچکترین ذره سازنده یک عنصر است که خود آن از ذرات زیر تشکیل شده است:
- پروتون
- نوترون
- الکترون
پروتون ها و نوترون ها هسته را تشکیل می دهند که جرم هر اتم به هسته آن بر می گردد و
فضای اطراف هسته را الکترون ها احاطه کرده اند که رفتار شیمیایی هر اتم به الکترون های آن مربوط می شود.
2# هسته (Nucleus)
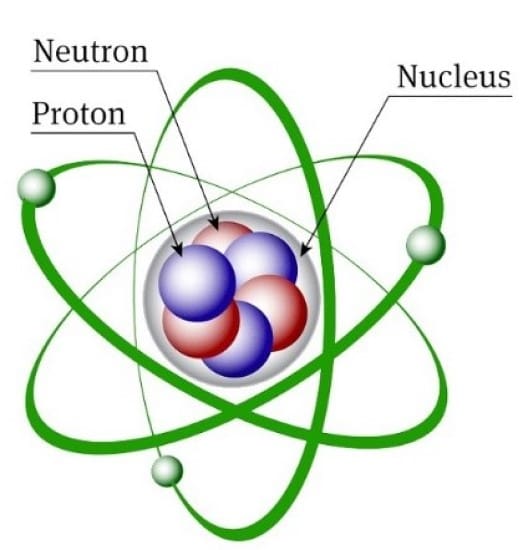
هسته در سال 1911 توسط ارنست رادرفورد، فیزیکدان نیوزلندی کشف شد.
در سال 1920، رادرفورد نام پروتون را برای ذرات دارای بار مثبت اتم پیشنهاد داد.
وی همچنین نظریه پردازی کرد که معتقد است در هسته یک ذره خنثی وجود دارد که
جیمز چادویک، فیزیکدان انگلیسی و دانشجوی رادرفورد در سال 1932 توانست آن را تأیید کند.
تقریباً تمام جرم یک اتم در هسته آن قرار دارد.
پروتون ها و نوترون های تشکیل دهنده هسته تقریباً جرم یکسانی دارند (پروتون کمی کمتر است) و حرکت زاویه ای یا چرخش یکسان دارند.
در ساختار اتم، هسته توسط یک نیروی قوی، به هم متصل است.
این نیرو بین پروتون ها و نوترون ها بر نیروی الکتریکی دافعه غلبه می کند که
اگر در غیر این صورت بود پروتون ها از هم دور می شدند.
برخی از هسته های اتمی ناپایدار هستند؛ زیرا نیروی اتصال برای اتم های مختلف بر اساس اندازه هسته متفاوت است.
در نتیجه این اتم ها به عناصر دیگری تبدیل می شوند.
3# پروتون در ساختار اتم

در ساختار اتم پروتون ها ذرات دارای بار مثبت هستند که در هسته های اتمی یافت می شوند.
رادرفورد آن ها را بین سال های 1911 تا 1919 در آزمایش با لوله های اشعه کاتد کشف کرد.
جرم پروتون ها تقریباً ٪99.86 جرم نوترون ها می باشد.
تعداد پروتون های یک اتم مخصوص هر عنصر است.
به عنوان مثال، اتم های هیدروژن یک پروتون، اتم های کربن دارای 6 و اتم های اکسیژن دارای 8 پروتون هستند.
در واقع تعداد پروتون های هر اتم عدد اتمی آن عنصر است.
همین طور رفتار شیمیایی عنصر نیز مرتبط با تعداد پروتون ها بوده و توسط آن ها تعیین می شود.
چیدمان عناصر در جدول تناوبی به ترتیب افزایش عدد اتمی می باشد.
4# نوترون در ساختار اتم

طبق گفته انجمن فیزیکی آمریکا، وجود نوترون توسط رادرفورد در سال 1920 تئوریزه شد و
در سال 1932 توسط چادویک کشف شد.
نوترون ها طی آزمایشی هنگام شلیک اتم ها به یک ورق نازک از جنس بریلیم، کشف شدند.
نوترون ها به شکل ذرات زیر اتمی بدون بار آزاد شدند.
در ساختار اتم نوترون ها ذرات بدون بار هستند که در تمام هسته های اتمی (به جز هیدروژن) یافت می شوند.
جرم نوترون نسبت به پروتون کمی بزرگتر است.
5# الکترون در ساختار اتم
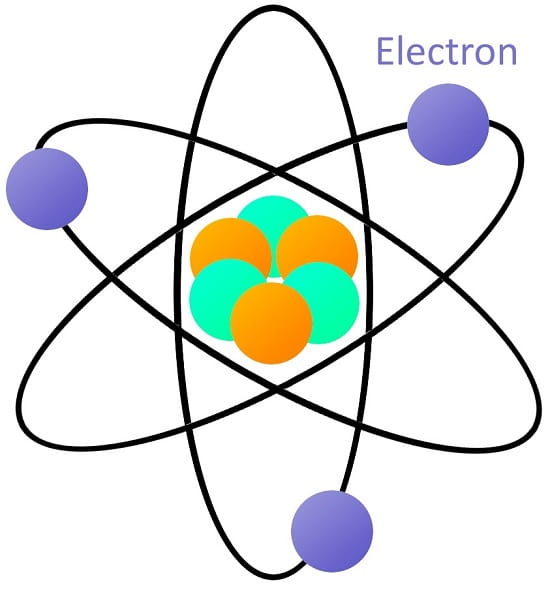
در ساختار اتم الکترون ها در مقایسه با پروتون ها و نوترون ها بسیار کوچک (بیش از 1800 برابر کوچکتر از پروتون یا نوترون) هستند.
طبق آزمایش جفرسون، الکترون ها در حدود ٪۰.۰۵۴ نوترون ها جرم دارند.
طبق اطلاعات موسسه تاریخ علم، جوزف جان تامسون، فیزیکدان بریتانیایی، الکترون را در سال 1897 کشف کرد.
الکترون ها دارای بار منفی هستند و از نظر الکتریکی جذب پروتون های مثبت می شوند.
در دهه ۱۹۲۰ ایده ای توسط اروین شرودینگر، فیزیکدان اتریشی، مطرح شد که
مطابق آن هسته اتم توسط الکترون ها در مسیرهایی به نام اوربیتال احاطه شده اند.
اوربیتال های داخلی اطراف اتم کروی هستند، اما اوربیتال های خارجی بسیار پیچیده تر می باشند.
چینش الکترون در یک اتم، به مکان های الکترون ها در آن اتم اشاره دارد.
با توجه به آزمایش لوس آلاموس، شیمیدان ها با استفاده از چینش الکترون و اصول فیزیک، می توانند خصوصیات یک اتم مانند پایداری، نقطه جوش و رسانایی را پیش بینی کنند.
6# عدد جرمی
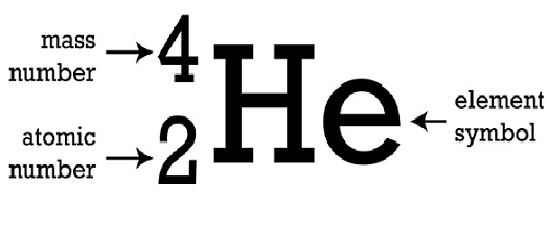
عدد جرمی (mass number) یک عنصر مجموع تعداد پروتون ها و تعداد نوترون ها است که آن را با نماد A نشان می دهند.
تنها سهم اندکی از عدد جرمی مربوط به جرم الکترون است که در محاسبه عدد جرمی نادیده گرفته می شود.
از این تقریب جرم می توان به راحتی برای محاسبه تعداد نوترون های یک عنصر، با کم کردن تعداد پروتون ها از عدد جرمی استفاده کرد.
در ساختار اتم، پروتون ها و نوترون ها هر دو تقریباً یک واحد جرم اتمی (amu) وزن دارند.
7# ایزوتوپ
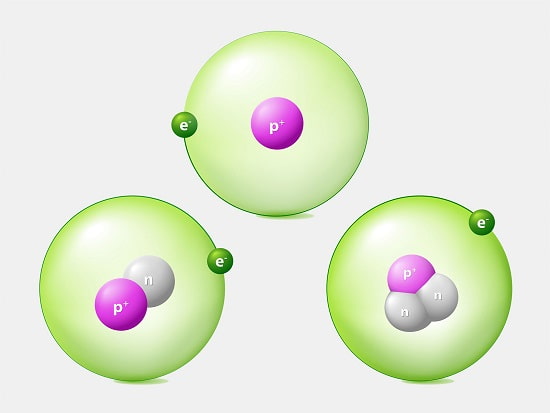
ایزوتوپ ها اشکال موجود عنصری هستند که تعداد پروتون های آن ها یکسان است؛
اما تعداد نوترون های آن ها متفاوت است.
برخی از عناصر مانند کربن، پتاسیم و اورانیوم دارای چندین ایزوتوپ طبیعی هستند.
ایزوتوپ ها ابتدا توسط عنصر خود و سپس توسط مجموع پروتون ها و نوترون های موجود تعریف می شوند.
لازم به ذکر است در ساختار اتم با وجود این که جرم ایزوتوپ های مختلف متفاوت است،
اما خصوصیات فیزیکی و شیمیایی آن ها در بیشتر موارد بدون تغییر باقی می ماند.
 |
نظرتون درباره این مقاله چیه؟
ما رو راهنمایی کنید تا اون رو کامل تر کنیم و نواقصش رو رفع کنیم.
توی بخش دیدگاه ها منتظر پیشنهادهای فوق العاده شما هستیم.



سلام چنتا سوال داشتم
1)فضای بین الکترون و پروتون یا خلع هست؟
2) با وجود اینکه الکترونهای اتم مدام در حرکت هستند اگر هر مادهای از اتم درست شده ،که در اتم ها الکترونهای هستند که مدام در حرکت هستند ،چطور مواد به خودی خود حرکت نمیکنند ؟
3). اگر بشود جلوی حرکت الکترون را گرفت چه اتفاقی میافتد
4) آیا با قراردادن اتم ها در میدان مغناطیسی خیلی قوی میشود جلوی حرکت الکترون ها را گرفت یا سرعت الکترونها را کم یا زیادتر کرد ؟
5) اگر بشود مواد مختلف را در میدان مغناطیسی بسیار قوی قرارداد آیا با ایجاد اخلال در حرکت پروتونها و الکترونها میشود ماده جدید درست کرد؟
6) آیا با ایجاد اخلال در حرکت الکترونها و پروتونها شاهد حالتی شبیه مرگ ستارها خواهیم بود
سلام همراه گرامی
ضمن تشکر بابت حضورتون در سایت ما
درباره پرسش هایی که مطرح فرمودید باید خدمتتون عرض کنم که مواردی که شما به اون ها اشاره کردید همگی نیازمند درک و شناخت تخصصی از ساختار اتم و ویژگی های ذرات درون اون هستند که پاسخ به تمام این موارد در قالب پاسخ به یک دیدگاه در سایت آموزشی توسط ما میسر نیست متاسفانه و نیاز هست شما با یک فرد متخصص در زمینه علوم فیزیک اتمی در ارتباط باشید.
موید باشید