قوانین ترمودینامیک پایه و اساس فهم علم ترمودینامیک هستند.
هر یک از این قوانین به بررسی تغییرات کمیت های مهم ترمودینامیکی از جمله دما می پردازد.
در این مقاله قصد داریم به معرفی چهار قانون اصلی ترمودینامیک بپردازیم.
تا پایان با ما همراه باشید.
قوانین ترمودینامیک
علم ترمودینامیک بر اساس چهار قانون کلی پایه ریزی شده است.
در هر یک از این قوانین چهارگانه اصول کلی مطرح شده است که
تنها در صورت فهم و پذیرش آن ها می توان سایر مفاهیم ترمودینامیکی را به کار گرفت.
ترمودینامیک به طور کلی علم بررسی رفتار خواص و متغیرهای اصلی اجسام و پدیده های طبیعی است.
برای تحلیل دقیق رفتار متغیرهای ترمودینامیک لازم است که مجموعه ای از اصول را بپذیریم.
در ادامه به شرح این اصول می پردازیم.

1# قانون صفرم از مجموعه قوانین ترمودینامیک
مجموعه قوانین ترمودینامیک با یک اصل ساده اما بسیار مهم آغاز می شود.
این اصل با عنوان قانون صفرم، روی تعادل حرارت میان سیستم های ترمودینامیکی تمرکز دارد.
قانون صفر ترمودینامیک بیان می کند که
اگر دو سیستم به صورت جداگانه با یک سیستم ثالث در تعادل حرارتی باشند، آنگاه آن دو سیستم نیز با هم در تعادل حرارتی هستند.
منظور از تعادل حرارتی این است که انتقال حرارت بین سیستم های ترمودینامیکی رخ نمی دهد.
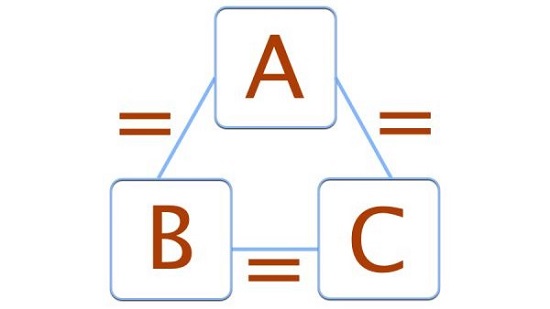
دو سیستم A و B را در نظر بگیرید.
سیستم دیگری با نام C در مجاورت این دو قرار می دهیم.
اگر سیستم A با C و همچنین سیستم B با C در تعادل حرارتی به سر ببرند،
آن گاه می توان گفت که دو سیستم A و B نیز با هم در تعادل هستند.
2# قانون اول ترمودینامیک
قانون اول از مجموعه قوانین ترمودینامیک به اصل بقای انرژی اشاره دارد.
مطابق قانون اول ترمودینامیک انرژی نه به وجود می آید و نه از بین می رود؛
بلکه صرفا از یک حالت به حالت دیگر تغییر شکل می دهد.
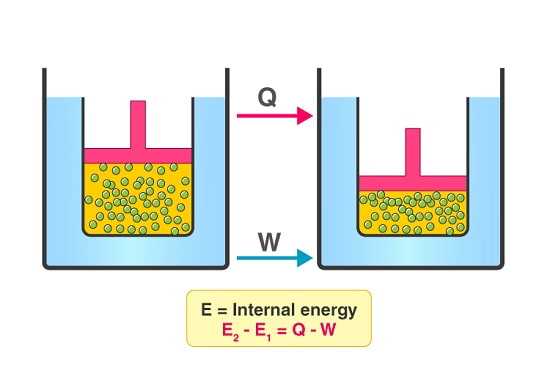
انرژی بین سیستم های ترمودینامیکی و محیط اطراف آن ها به دو صورت گرما (q) و کار (w) انتقال پیدا می کند.
بنابراین تغییرات انرژی داخلی یک سیستم ترمودینامیکی را می توان از طریق رابطه ریاضی زیر محاسبه نمود:
ΔE = q + w
با توجه به این معادله، هر گونه افزایش انرژی در یک سیستم ترمودینامیکی به صورت کاهش انرژی در محیط اطراف ظاهر می شود.
به مثال ساده ای در این خصوص توجه کنید.
گیاهان با استفاده از انرژی تابشی خورشید عملیات فتوسنتز انجام می دهند و
در نهایت آن را به صورت انرژی شیمیایی در می آورند.
پس از به بار نشستن محصولات، ما آن ها را می خوریم و
به این ترتیب انرژی شیمیایی نهفته در گیاهان وارد بدن ما می شود.
این انرژی در بدن ما به انرژی حرارتی و جنبشی تبدیل می گردد.
انرژی حرارتی و جنبشی از بدن ما به محیط اطراف منتقل می شود.
به همین ترتیب چرخه تبدیل انرژی از یک حالت آغاز و به حالت دیگر ادامه پیدا می کند.
3# قانون دوم از مجموعه قوانین ترمودینامیک
قانون دوم از مجموعه قوانین ترمودینامیک به بررسی مفهومی به نام آنتروپی (Entropy) در سیستم های ترمودینامیکی می پردازد.
تعاریف مختلفی برای آنتروپی ذکر شده اند که در ادامه به برخی از مهم ترین آن ها اشاره می کنیم.
در قانون دوم ترمودینامیک هر سیستم ترمودینامیکی به صورت خود به خود به سمت تعادل حرارتی در حرکت است.
با این نگرش اگر جهان هستی را به چشم یک سیستم ترمودینامیکی بنگریم، آنتروپی آن مدام در حال افزایش است.

تعبیر دیگری نیز برای قانون دوم ترمودینامیک وجود دارد.
در یک فرآیند ترمودینامیکی به صورت خود به خود، تمایل سیستم به سمت افزایش آنتروپی است.
در نتیجه حتی اگر در یک فرآیند ترمودینامیکی، آنتروپی سیستمی کاهش پیدا کند، به این معنی است که
آنتروپی محیط اطراف آن افزایش یافته و حاصل جمع تغییرات آنتروپی سیستم و محیط اطرافش حتما بزرگ تر از صفر است.
1-3# تعاریف مختلف آنتروپی
به اعتقاد برخی از متخصصان در بین مجموعه قوانین ترمودینامیکی، قانون دوم اهمیت بیشتری دارد.
برای فهم بهتر مفهوم این قانون لازم است که با تعریف آنتروپی آشنا باشیم.
همان طور که اشاره کردیم تعاریف مختلفی برای این مفهوم از دیدگاه های گوناگون ارائه شده است.
از جمله مهم ترین تعاریف آنتروپی می توان به موارد زیر اشاره کرد:
- آنتروپی بیانگر بی نظمی یا عدم قطعیت یک سیستم ترمودینامیکی است.
- آنتروپی به میزان حرارتی گفته می شود که نمی توان صرف انجام کار ترمودینامیکی کرد.
یکای اندازه گیری آنتروپی مشابه انرژی، ژول است.
در این قسمت بد نیست که مثالی نیز از مفهوم آنتروپی بزنیم.
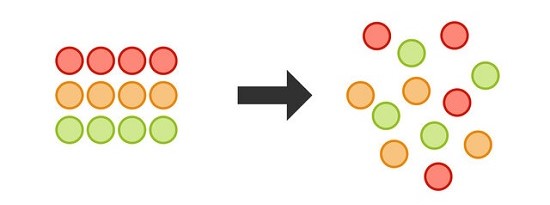
یک اتاق را در نظر بگیرید که تمام وسایل در آن به طور منظم چیده شده اند.
به مرور زمان با استفاده از وسایل، نظم و ترتیب در اتاق بر هم می خورد.
در صورتی که اقدامی برای مرتب کردن اتاق انجام نشود، به صورت خود به خود بی نظمی در آن افزایش پیدا می کند.
آنتروپی نیز رابطه مستقیم با بی نظمی موجود در سیستم های ترمودینامیکی دارد.
4# قانون سوم از مجموعه قوانین ترمودینامیک
در ادامه معرفی قوانین ترمودینامیک، نوبت به قانون سوم می رسد.
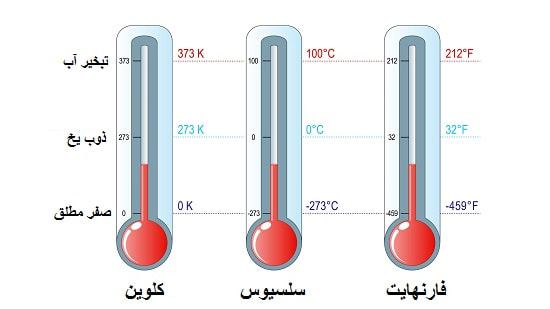
در قانون سوم ترمودینامیک بیان می شود که آنتروپی یک ماده کریستالی خالص در دمای صفر مطلق برابر با صفر است.
منظور از دمای صفر مطلق همان دمای صفر کلوین است که حدود 273- درجه سانتی گراد برآورد می شود.
برای درک این قانون بد نیست که از آب به عنوان مثال کاربردی استفاده کنیم.
در فشار اتمسفر، آب در دمای بالای 100 درجه سلسیوس به صورت گاز است.
مولکول های بخار آب در این حالت به صورت آزادانه در گردش هستند و اصطلاحا بی نظمی آن ها زیاد است.
در نتیجه می توان گفت بخار آب آنتروپی بالایی دارد.
با سرد کردن بخار آب تا دمای زیر 100 درجه سلسیوس، تغییر فاز در آن رخ می دهد و به حالت مایع در می آید.
دامنه حرکت مولکول های آب در فاز مایع نسبت به گاز محدودتر است.
در نتیجه می توان گفت که آنتروپی آب مایع کمتر از بخار آن است.
اگر فرآیند سرد کردن آب را ادامه دهیم تا به زیر صفر درجه سلسیوس برسد، باز هم در اثر تغییر فاز به حالت جامد در می آید.
دامنه حرکت مولکول های یخ به مراتب کمتر از مایع است و در نتیجه آنتروپی آن نیز کمتر است.
حال اگر فرآیند سرد کردن یخ را تا دمای صفر مطلق ادامه دهیم، در شرایط ایده آل آنتروپی آن به صفر می رسد.
البته لازم به ذکر است که در واقعیت امکان دستیابی به دمای صفر مطلق وجود ندارد.
 |
نظرتون درباره این مقاله چیه؟
ما رو راهنمایی کنید تا اون رو کامل تر کنیم و نواقصش رو رفع کنیم.
توی بخش دیدگاه ها منتظر پیشنهادهای فوق العاده شما هستیم.



از مطالب شما استفاده کردم و بسبار متشکرم. من محل کارم تغییر مرده و به اجبار باید علم مهندسی مواد رو آموزش ببینم.و با تخصیلات من خیلی متفاوت است.
سلام سرکار خانم سعدی
ممنون از محبتی که به ما دارید و همراهی سایت ما
بسیار خوشحالیم که این مطالب در مسیر تغییر شغلی شما کمک کننده واقع شده.
درباره موضوع علم مواد هم ما یک آموزش جامع داریم که پیشنهاد میکنم حتما صفحه این آموزش رو در سایت بررسی بفرمایید، اگر مناسب نیازهای شما برای این حوزه باشه، ارائه خدمات به شما باعث افتخار ماست.
لینک آموزش علم موادموفق باشید.