آنتالپی یکی از پارامترهای مهم ترمودینامیکی است که به نوعی معرف شکل خاصی از انرژی در مواد است.
این پارامتر کمیتی مقداری است و رد پای آن در بسیاری از روابط ترمودینامیک مشاهده می شود.
به همین دلیل تصمیم گرفتیم که در یک مقاله به بررسی آن بپردازیم.
تا پایان مطلب حاضر با ما همراه باشید.
1# آنتالپی چیست؟
در یک سیستم ترمودینامیکی به مجموع انرژی داخلی و حاصل ضرب فشار در حجم اصطلاحا آنتالپی (Enthalpy) می گویند.
این پارامتر در ردیف کمیت های مقداری قرار می گیرد و با انرژی حرارتی جسم رابطه مستقیم دارد.
در واقع می توان آن را معرف میزان گرمای موجود در یک سیستم ترمودینامیکی تلقی کرد.
یکای اندازه گیری این کمیت مانند انرژی، ژول (J) است.
Enthalpy را می توان یک تابع حالت از سیستم های ترمودینامیکی دانست که
در ارتباط مستقیم با دما، فشار و حجم سیستم قرار دارد.
در فرمول های ترمودینامیکی، این کمیت را با نماد H نشان می دهند.
بر اساس تعریفی که در ابتدا برای آن ارائه کردیم، رابطه ریاضی آنتالپی به شرح زیر است:
H = U + PV
نمادها در رابطه بالا عبارت اند از:
- U: انرژی درونی
- P: فشار
- V: حجم سیستم ترمودینامیکی
بنابر قانون بقای انرژی، تغییر انرژی درونی سیستم تابعی از تغییر دمای آن است.
به همین دلیل است که علاوه بر فشار و حجم، دما نیز عاملی تعیین کننده در مقدار Enthalpy یک سیستم ترمودینامیکی است.
2# رابطه بین گرما و آنتالپی
در بالا اشاره کردیم که آنتالپی به نوعی معرف میزان انرژی حرارتی موجود در یک سیستم ترمودینامیکی است.
سؤال مهم این است که در یک فرآیند ترمودینامیکی چه رابطه ای بین گرمای منتقل شده و تغییر Enthalpy وجود دارد.
بر اساس رابطه ریاضی که در بالا ذکر کردیم، تغییر Enthalpy در یک فرآیند ترمودینامیکی به صورت زیر محاسبه می شود:
ΔH = ΔU + Δ(PV)
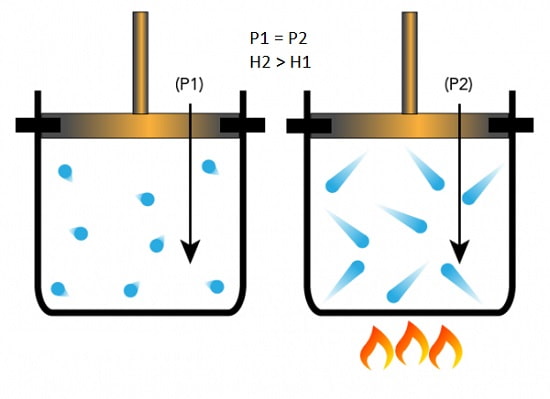
اگر چنانچه در طول فرآیند ترمودینامیکی، فشار ثابت باقی بماند، رابطه فوق به صورت زیر در می آید:
ΔH = ΔU + PΔV
طرف راست معادله فوق دقیقا معرف گرمای منتقل شده در یک فرآیند ترمودینامیکی است.
اگر گرما را با نماد Q معرفی کنیم، در یک فرآیند ترمودینامیکی با فشار ثابت، رابطه بین گرما و آنتالپی به صورت زیر تعریف می شود:
ΔH=Q
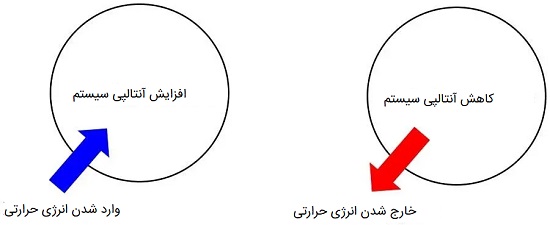
طبق رابطه بالا چنانچه گرما به سیستم وارد شود، شاهد افزایش Enthalpy آن خواهیم بود.
برعکس اگر حرارت از سیستم ترمودینامیکی به محیط اطراف انتقال پیدا کند، Enthalpy در آن کاهش می یابد.
3# آنتالپی ویژه چیست؟ (Specific Enthalpy)
تا اینجا با مفهوم آنتالپی آشنا شدیم.
Enthalpy یک کمیت مقداری گسترده است.
به این معنی که جرم سیستم به طور مستقیم روی تعیین مقدار آن اثرگذار است.
در کنار این مفهوم، کمیت دیگری به نام آنتالپی ویژه (Specific Enthalpy) تعریف می شود که به هیچ عنوان به جرم سیستم وابسته نیست.
رابطه ریاضی آن نیز به صورت زیر است:
h = H/M
نمادها در رابطه فوق عبارت اند از:
- M: جرم
- h: آنتالپی ویژه
یکای اندازه گیری آن نیز به صورت ژول بر واحد جرم است که
عمدتا در مسائل ترمودینامیکی به شکل کیلوژول بر کیلوگرم (KJ/Kg) تعریف می شود.
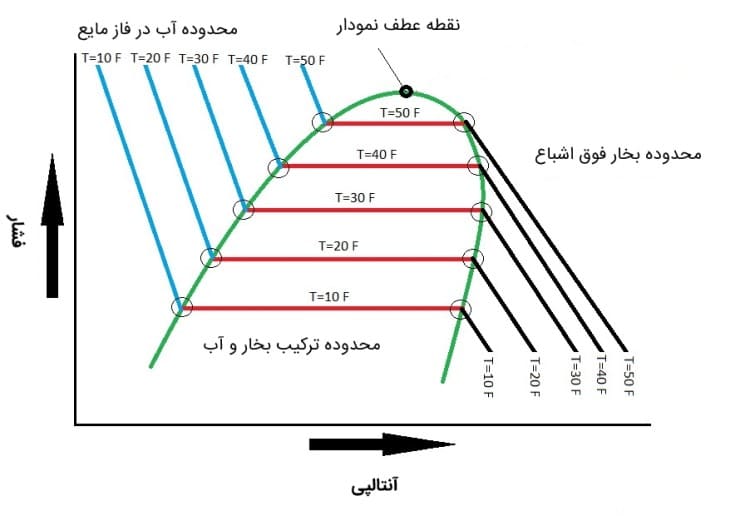
تعریف این کمیت باعث می شود که بتوان در آزمایشگاه ها آنتالپی ویژه را برای سیالات مختلف به صورت تجربی اندازه گیری و اعداد به دست آمده را در قالب جداول ترمودینامیکی گردآوری کرد.
به عنوان مثال می توان به جداول ترمودینامیکی مربوط به آب در کتاب های مرجع ترمودینامیک اشاره نمود.
در این جداول Enthalpy ویژه آب (در حالت های مختلف مایع و گاز) در دما و فشارهای مختلف ارائه شده است.
به این ترتیب برای حل مسائل ترمودینامیکی می توان به راحتی به جداول مذکور مراجعه نمود و داده های مورد نیاز را استخراج کرد.
4# معرفی تغییرات مختلف Enthalpy
تغییر آنتالپی زمانی رخ می دهد که یک ماده دست خوش تغییرات فیزیکی یا شیمیایی شود.
بر این اساس تغییرات مختلف Enthalpy را می توان به صورت زیر برشمرد:
Enthalpy واکنش
اشاره به تغییر Enthalpy در زمانی که یک ماده وارد واکنش شیمیایی می شود، دارد.
Enthalpy احتراق
به تغییر Enthalpy در زمانی که یک ماده با اکسیژن وارد واکنش شده و می سوزد، گفته می شود.
Enthalpy تشکیل
تغییر Enthalpy در اثر تشکیل یک ماده از عناصر سازنده اش را آنتالپی تشکیل می گویند.
Enthalpy محلول
تغییر Enthalpy یک محلول است که به طور کامل در یک ماده حلال حل می شود.
Enthalpy همجوشی
اشاره به تغییر Enthalpy یک ماده در اثر تغییر حالت از فاز جامد به مایع دارد.
Enthalpy تصعید
اشاره به تغییر Enthalpy یک ماده در اثر تغییر حالت از فاز جامد به گاز (تصعید) دارد.
Enthalpy تبخیر
اشاره به تغییر Enthalpy یک ماده در اثر تغییر حالت از فاز مایع به گاز دارد.
Enthalpy اختلاط
به تغییر Enthalpy در اثر ترکیب شدن دو ماده با هم بدون رخ دادن هیچ گونه واکنش شیمیایی میان آن ها گفته می شود.
 |
اگر به دنبال یاد گرفتن مهارت بیشتر و افزایش درآمد هستید،
برای دریافت آموزش های رایگان مرتبط با حوزه علاقهمندی خود فقط کافیه فرم رو تکمیل کنید.
نظرتون درباره این مقاله چیه؟
ما رو راهنمایی کنید تا اون رو کامل تر کنیم و نواقصش رو رفع کنیم.
توی بخش دیدگاه ها منتظر پیشنهادهای فوق العاده شما هستیم.







ثبت ديدگاه