به دلیل وجود عناصر مختلف در جهان، دسته بندی عنصرها باعث می شود که
بتوانیم آن ها را به خوبی بشناسیم، از خواص آن ها آگاهی کامل داشته باشیم تا
به درستی در موارد مختلف از آن ها استفاده کنیم.
اگر شما هم به دنبال آشنایی با روش های دسته بندی عنصر ها هستید این مقاله انتخاب مناسبی برای شماست.
در این مقاله به توضیح روش های معمول برای دسته بندی عنصرها می پردازیم. با ما همراه باشید.
1# دسته بندی عنصرها (Category of Elements)
مطالعه جداگانه هر عنصر و دانستن خواص آن ها دشوار است.
از این رو در دسته بندی عنصرها عناصری که با یکدیگر ویژگی های مشابه دارند را در یک گروه قرار می دهند.
بر اساس این ویژگی ها، سرانجام دانشمندان موفق شدند عناصر مختلف را در خانواده های شیمیایی دسته بندی کنند، به طوری که عناصر مشابه در کنار هم قرار گرفتند و عناصر غیرمشابه از یکدیگر جدا شدند.
از مزایای دسته بندی عنصرها عبارت اند از:
- کمک به درک خواص عنصر و ترکیبات آن
- مطالعه، مقایسه و تشخیص خواص عناصر و ترکیبات آن ها
بنابراین، دسته بندی عنصرها منجر به تشکیل جدول مندلیف شد که به شیمیدانان کمک کرده است تا
خواص عناصر و ترکیبات آن ها را به طور سیستماتیک و منظم تر مطالعه و درک کنند.
2# جدول تناوبی (Periodic Table)
جدول تناوبی که به افتخار پایه گذار آن جدول مندلیف نیز نامیده می شود، یکی از اصلی ترین و مهم ترین روش های دسته بندی عنصرها است.
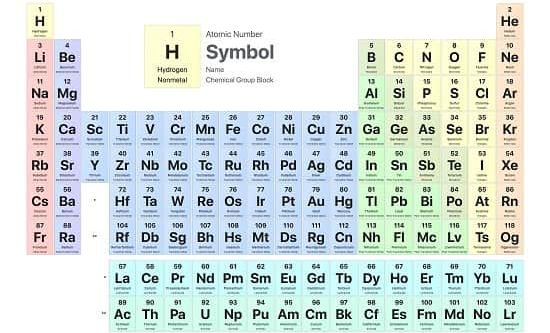
در جدول مندلیف هر عنصری دارای یک نماد (Symbol) است که با حرف اول بزرگ انگلیسی آن نمایش داده می شود.
هر عنصر در این جدول دارای یک عدد اتمی (Atomic Number) است که با تعداد پروتون های اتم آن عنصر معادل است.
هر چه تعداد پروتون های یک عنصر یا عدد اتمی آن بیشتر باشد آن عنصر سنگین تر است.
همان طور که می دانیم اتم های یک عنصر می توانند دارای تعداد نوترون متفاوتی باشند که به آن ها ایزوتوپ (Isotope) می گوییم.
همه عناصر دارای ایزوتوپ هستند.
بسیاری از ایزوتوپ های عناصر مختلف ناپایدار یا رادیواکتیو می باشند و از این رو متلاشی می شوند.
در جدول تناوبی میانگین این ایزوتوپ ها را به صورت “جرم اتمی” در زیر عناصر قرار داده اند.
جدول تناوبی اتم ها را براساس افزایش عدد اتمی مرتب می کند تا عناصر با خواص شیمیایی یکسان به صورت دوره ای تکرار شوند.
الکترون های ظرفیتی نیز عامل تعیین کننده در برخی از خواص فیزیکی عناصر هستند.
جدول مندلیف توسط 18 گروه و 7 ردیف تقسیم بندی شده است که در ادامه به توضیح آن ها می پردازیم.
3# گروه های اصلی جدول تناوبی
عناصری که در یک گروه قرار می گیرند، ویژگی های نزدیک به هم دارند.
این عناصر در لایه آخر الکترونی خود دارای تعداد الکترون برابر هستند.
روندهای تناوبی که در بین عناصر گروه های جدول مندلیف رخ می دهد به صورت زیر است:
- به دلیل برابر بودن آرایش الکترونی لایه آخر آن ها، عناصر یک گروه ویژگی های شیمیایی یکسان و مشابهی با هم دارند.
هرچه عدد اتمی آن ها افزایش پیدا کند این شباهت شیمیایی بین عناصر یک گروه نیز افزایش پیدا می کند. - با افزایش عدد اتمی (وقتی عناصر را از بالا به پایین بررسی کنیم) شعاع اتمی عناصر نیز افزایش می یابد.
با افزایش شعاع اتمی خاصیت فلزی عناصر نیز افزایش می یابد.
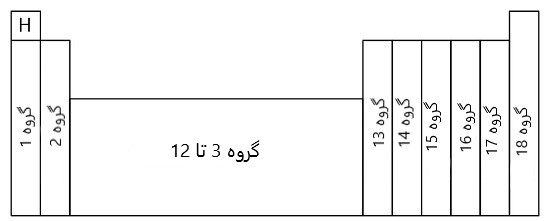
همان طور که گفتیم دسته بندی عنصرها در گروه های جدول تناوبی از 1 تا 18 نام گذاری شده اند که آن ها را توضیح می دهیم.
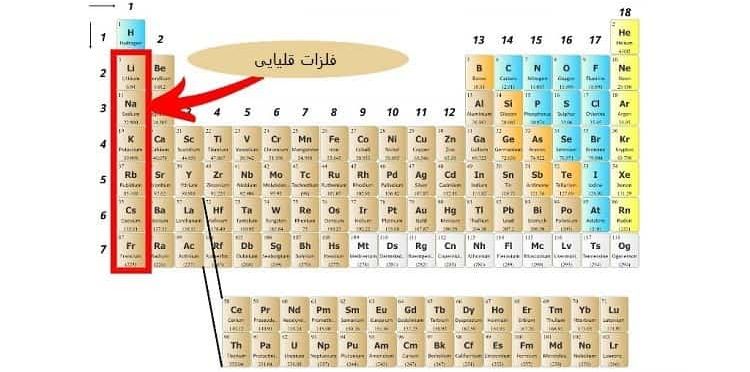
1-3# دسته بندی عنصرها در گروه اول
به عناصری که در گروه اول قرار دارند “فلزات قلیایی (Alkali Metals)” می گویند.
ویژگی عناصر این گروه شامل موارد زیر می شود:
- نقطه ذوب پایین
- نقطه جوش پایین
- انعطاف پذیری
- چگالی پایین
با نگاه کردن به دسته بندی عنصرها در گروه اول، هیدروژن را می بینیم که اولین عنصر در جدول مندلیف است.
این عنصر به دلیل خواص متفاوتی که با عناصر گروه اول دارد، از نظر شباهت های شیمیایی جزء این گروه به حساب نمی آید.
عناصر گروه اول، در لایه ظرفیت خود تنها دارای 1 الکترون هستند؛ پس به راحتی می توانند در واکنش های شیمیایی شرکت کنند.
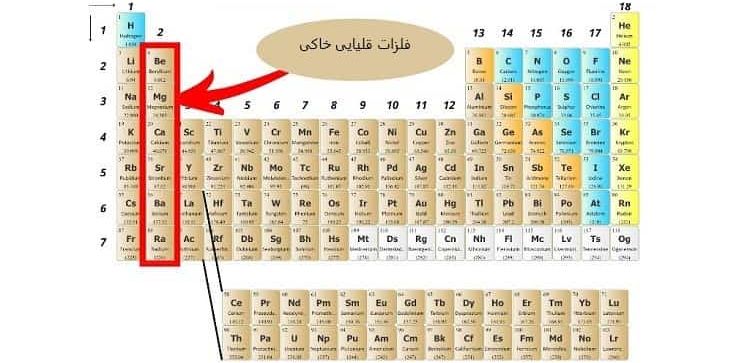
2-3# دسته بندی عنصرها در گروه دوم
در دسته بندی عنصرها، گروه دوم به “فلزات قلیایی خاکی (Alkaline Earth Metals)” معروف هستند.
این گروه نسبت به گروه 1 واکنش پذیری کمتری دارند؛ زیرا در لایه ظرفیت خود دارای 2 الکترون هستند.
ویژگی های فلزات قلیایی خاکی عبارت اند از:
- فلزات سخت
- چگالی بالا
- دمای ذوب بالا
- ایجاد رنگ در مقابل شعله
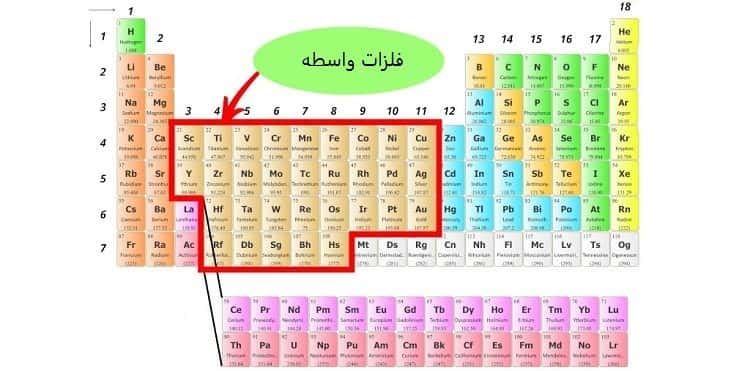
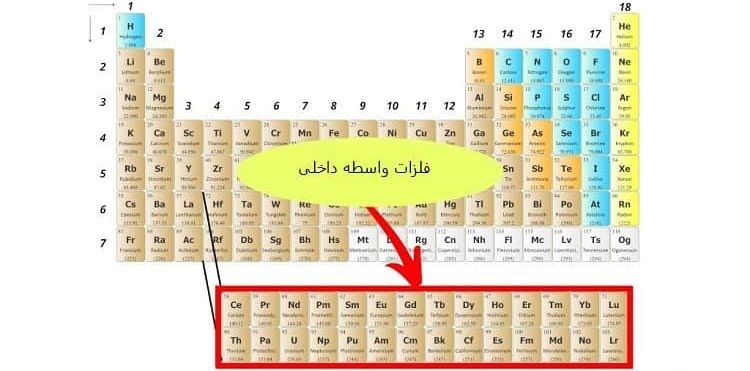
3-3# دسته بندی عنصرها در گروه های 3 تا 12
عناصری که از گروه 3 تا 12 قرار دارند “فلزات واسطه (Transition Metals)” نامیده می شوند.
همه عناصر واسطه جزء فلزات هستند و به همین دلیل انعطاف پذیری بالایی دارند.
در دسته بندی عنصرها در این گروه ها، عنصر جیوه نیز قرار دارد.
این عنصر تنها فلزی است که حالت مایع دارد.
ویژگی های فلزات واسطه عبارت اند از:
- تشکیل ترکیبات رنگی
- واکنش پذیری کم
- فلزات بسیار سخت
- رسانای الکتریسیته
- چگالی بالا
- نقطه جوش بالا
نکته قابل توجه این است که دو عنصر لانتان (la) و عنصر اکتینیم (Ac) در گروه 3 هستند؛ اما جزء فلزات واسطه به حساب نمی آیند.
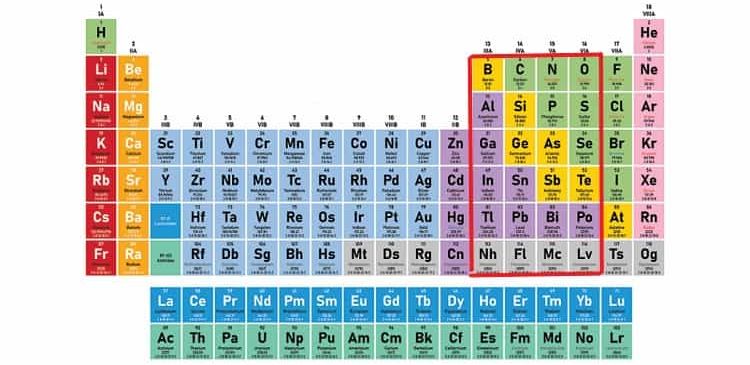
4-3# دسته بندی عنصرها در گروه های 13 تا 16
این گروه از عناصر مهمی مثل شبه فلز بور (Boron) و فلزاتی مانند آلومینیوم (Aluminium) تشکیل شده اند.
عناصر مهمی که در بین این 4 گروه قرار دارند عبارت اند از:
- کربن (Carbon)
- سیلیسیم (Silicon)
- نیتروژن (Nitrogen)
- فسفر (Phosphorus)
- اکسیژن (Oxygen)
- فلوئور (Fluorine)
- کلر (Chlorin)
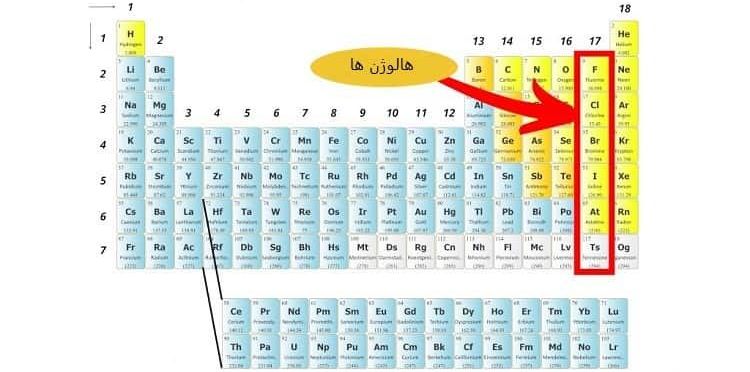
5-3# دسته بندی عنصرها در گروه 17
عناصر این گروه در دسته بندی عنصرها با جدول تناوبی، به “هالوژن ها (Halogen)” معروف هستند.
ویژگی های این عناصر عبارت اند از:
- آرایش نسبتاً پایدار
- واکنش پذیری بسیار بالا
- ایجاد ترکیبات خورنده
عنصرها در این گروه معمولاً به صورت آزادانه در طبیعت قرار ندارند و به صورت مولکول های دو اتمی دیده می شوند.
6-3# دسته بندی عنصرها در گروه 18
در دسته بندی عنصرها، گروه 18 گازهایی هستند که به اصطلاح به آن ها “گازهای نجیب (Noble Gases)” می گویند.
ویژگی های این عناصر عبارت اند از:
- آرایشی کاملاً پایدار
- از نظر شیمیایی غیرفعال
- قدرت الکترونگاتیوی کم
- نقطه ذوب کم
- تک اتمی
به این عناصر “گازهای بی اثر” نیز می گویند؛ زیرا آرایشی کاملاً پایدار دارند و
هیچ میلی به برقراری واکنش با عناصر دیگر و تشکیل ترکیبات مختلف ندارند.
یک نکته قابل توجه این است که عنصر اوگانسون (Og) هم جزء گروه 18 است؛
اما جزء گازهای نجیب به حساب نمی آید.
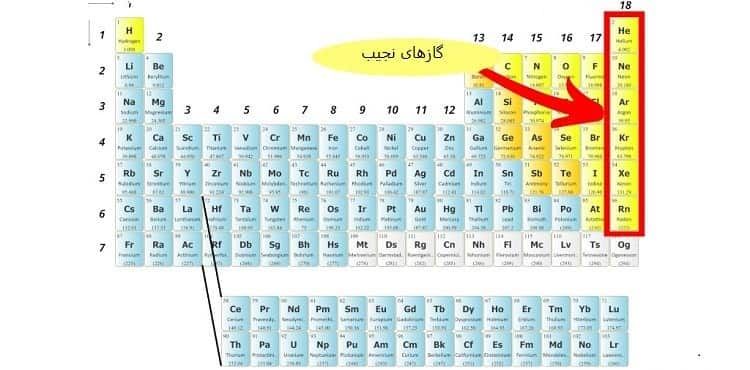
4# ردیف های جدول مندلیف
جدول تناوبی از 7 ردیف تشکیل شده است.
با توجه به جدول و دسته بندی عنصرها متوجه می شویم که
اولین عنصر هر دوره یک فلز قلیایی و آخرین عنصر هر دوره یک گاز نجیب هستند.
در یک ردیف، وقتی عناصر را از سمت چپ به راست بررسی می کنیم شعاع اتمی عناصر رو به کاهش است.
با کاهش شعاع اتمی در ردیف ها از چپ به راست، خاصیت فلزی عناصر نیز کاهش می یابد.
پس نتیجه می گیریم که خاصیت فلزی با شعاع اتمی رابطه مستقیم دارد.
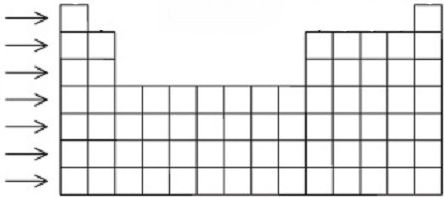
در دسته بندی عنصرها در جدول مندلیف، دو ردیف از عناصر جدا از بقیه ردیف ها در پایین جدول نمایش داده شده اند که به آن دو ردیف “عناصر واسطه داخلی (Inner-Transition Metals)” می گویند.
در اصل این عناصر باید در ردیف های ششم و هفتم قرار می گرفتند؛ اما به دلیل کمبود جا، این عناصر را به صورت جداگانه قرار داده اند.
یعنی از ادامه عنصر لانتان (la) و عنصر اکتینیم (Ac) این دو ردیف قرار گرفته اند.
همچنین این عناصر جزء فلزات محسوب می شوند.
5# دسته بندی عنصرها به روش های دیگر
گاهی اوقات ممکن است عناصر را به روش های دیگری دسته بندی کنند.
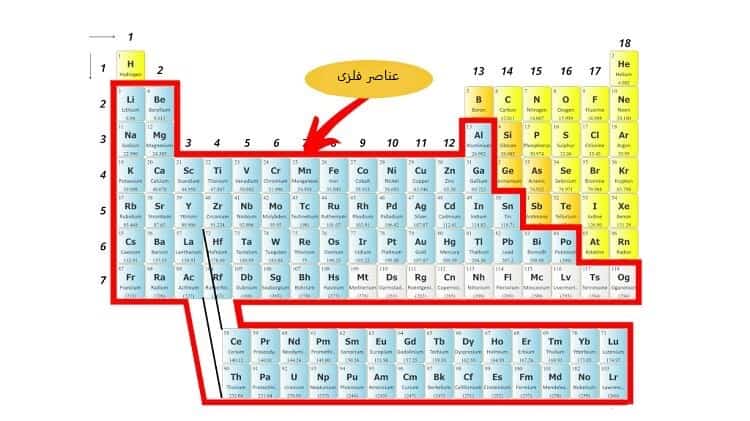
یکی از این روش ها دسته بندی عنصرها از نظر فلزی یا غیرفلزی بودن آن ها است که در ادامه به آن ها می پردازیم.
- عناصر فلزی (Metal)
عنصر فلزی عنصری است که اتم های آن میل به از دست دادن الکترون دارند.
از عناصر فلزی برای مصالح ساختمانی، کابل های برق، وسایل زینتی و موارد دیگر استفاده می شود.
ویژگی های این فلزات که معمولاً در سمت چپ جدول تناوبی یافت می شوند، عبارت اند از:
- رسانای الکتریسیته
- چکش خواری
- براق
- در برخی اوقات دارای خاصیت مغناطیسی
- عناصر نافلز (Non-Metals)
عناصر غیرفلزی عناصری هستند که اتم های آن ها میل به گرفتن الکترون دارند.
همچنین از عناصر نافلز مانند کلر (Chlorine)، برم (Bromine)، هیدروژن (Hydrogen)، گوگرد (Sulfur) و نیتروژن (Nitrogen) برای ساخت بسیاری از مواد شیمیایی رایج تجاری استفاده می شود.
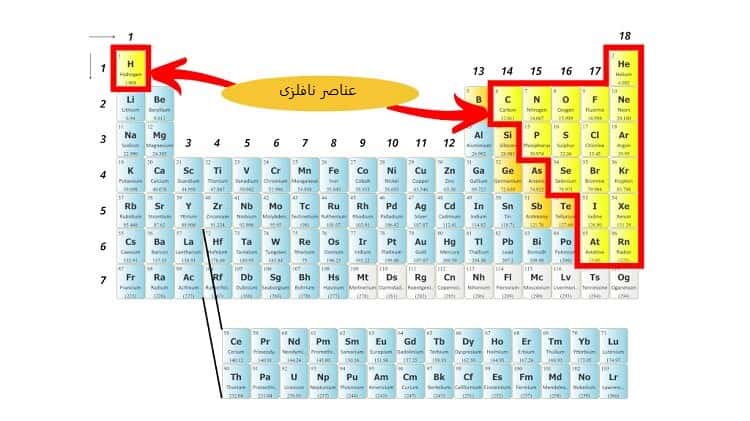
ویژگی های نافلزاتی که در سمت راست جدول تناوبی قرار دارند، عبارت اند از:
- نارسانا
- عدم چکش خواری
- مات
- نداشتن خاصیت مغناطیسی
 |
نظرتون درباره این مقاله چیه؟
ما رو راهنمایی کنید تا اون رو کامل تر کنیم و نواقصش رو رفع کنیم.
توی بخش دیدگاه ها منتظر پیشنهادهای فوق العاده شما هستیم.



بسیار عالی
سلام همراه محترم
سپاس از محبتتون
بسیار عالی بود. استفاده کردم
سلام همراه گرامی
سپاس از محبت شما
خرسندیم که رضایت داشتید
سلام ببخشید الان عناصر دستهf جزو کدام گروه محسوب می شوند؟۲یا۳؟
منظورم۲تا دسته۱۴تایی لانتانیدها و اکتینیدها هستش
سلام همراه گرامی
سال نو مبارک 🌷
از شما بابت همراهی تون با سایت نماتک متشکریم؛ اما با عرض پوزش ما یک مجموعه آموزشگاهی هستیم و در زمینه های فنی ارائه خدمات و مشاوره و دانش مرتبط برای پاسخگویی به سوالات تخصصی عزیزان رو در بخش کامنت های سایت نداریم.
تنها راه پیشنهادی ما این هست که از فضای فروم نماتک برای دریافت راهنمایی استفاده بفرمایید تا عزیزانی که در این زمینه دانش و شناخت کافی دارند، پاسخگوی سوالات شما باشند.
آدرس فروم نماتک: https://katibeha.com/
موفق باشید.
سلا شبتون بخیر
ببخشید عناصر اصلی کدام عنصرها هستند و همینطور عناصر فرعی کدام عنصرها هستند؟
سلام سرکار خانم
معمولا به عناصر موجود در گروه های ۱ و ۲ و گروه های ۱۳ تا ۱۸ اصلی گفته می شود و سایر عناصر موجود در گروه های ۳ تا ۱۲ عناصر فرعی یا واسطه هستند
از همراهی شما سپاسگزاریم
موفق باشید
متشکریم از زحمتتون دستت درد نکنه
سلام همراه گرامی
از لطف و محبت شما ممنونیم
موفق باشید
سلام
از خوندن مطالب خیلی لدت بردم.. سپاسگزارم
سلام خدمت شما بزرگوار
خیلی ممنون از همراهی شما با تیم نماتک.