حتما شما هم با سلول الکتروشیمیایی به عنوان یکی از منابع تولید انرژی الکتریکی آشنا هستید.
اما این سیستم چطور از یک ماده شیمیایی، برق تولید می کند؟ خواص و ویژگی های این سلول چیست؟
در این مقاله سعی داریم به تمامی پرسش های شما حول این موضوع پاسخ دهیم.
پس خواندن این متن را از دست ندهید.
1# سلول الکتروشیمیایی چیست؟
سلول الکتروشیمیایی وسیله ای است که می تواند از واکنش های شیمیایی رخ داده در آن انرژی الکتریکی تولید کند یا
از انرژی الکتریکی تأمین شده برای تسهیل واکنش های شیمیایی در آن استفاده کند.
این دستگاه ها قادر به تبدیل انرژی شیمیایی به انرژی الکتریکی یا بالعکس هستند.
این سلول ها در فرآیندهای پرکاربرد زیادی از جمله برقکافت، آبکاری فلزات و یا پالایش آن ها استفاده می شوند.
این وسیله در حقیقت یک وسیله کاربردی طراحی شده به کمک دو علم شیمی و برق است لذا
بر علم آموزان این دو زمینه واجب است که از کلیات این قطعه آگاه باشند.
سلول های الکتروشیمیایی که جریان الکتریکی تولید می کنند، سلول های ولتایی یا سلول های گالوانیک نامیده می شوند.
سلول های شیمیایی که واکنش های شیمیایی ایجاد می کنند (به عنوان مثال از طریق الکترولیز)، سلول های الکترولیتی نامیده می شوند.
یک نمونه متداول از سلول گالوانیک، یک باتری 1.5 ولتی استاندارد است که
برای استفاده مصرف کننده استفاده می شود.

یک باتری، متشکل از یک یا چند سلول است که به صورت موازی، سری یا سری و موازی به هم متصل شده اند.
2# ساختار سلول الکتروشیمیایی
یک سلول الکتروشیمیایی از دو نیمه سلول تشکیل شده است.
هر نیمه سلول از یک الکترود و یک الکترولیت تشکیل شده است.
ممکن است دو نیمه سلول از الکترولیت یکسان استفاده کنند یا ممکن است از الکترولیت های مختلفی استفاده کنند.
واکنش های شیمیایی سلول ممکن است شامل الکترولیت، الکترودها یا یک ماده خارجی باشد.
مانند سلول های سوختی که ممکن است از گاز هیدروژن به عنوان واکنش دهنده استفاده کنند.
یک پل نمکی (مانند کاغذ صافی آغشته به KNO3، NaCl یا برخی از الکترولیت های دیگر) اغلب برای ایجاد تماس یونی بین دو نیمه سلول با الکترولیت های مختلف استفاده می شود.
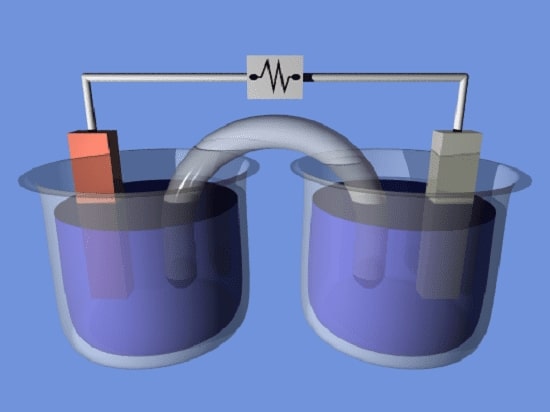
این پل های نمکی از مخلوط شدن محلول ها و ایجاد واکنش های جانبی ناخواسته جلوگیری می کنند.
یک گزینه جایگزین برای پل نمکی، تماس مستقیم بین دو نیمه سلول است که
این کار معمولا به کمک آب و الکترولیز کردن انجام می شود.
همانطور که الکترون ها از طریق یک مدار خارجی از یک نیم سلول به سلول دیگر می روند، اختلاف بار ایجاد می شود.
اگر هیچ تماس یونی فراهم نشود، این اختلاف بار به سرعت از جریان بیشتر الکترون جلوگیری می کند.
یک پل نمکی به جریان یون های منفی یا مثبت اجازه می دهد تا
توزیع بار حالت پایدار بین مخازن را حفظ کند.
 |
3# انواع سلول الکتروشیمیایی
سلول های شیمیایی انواع مختلفی دارند که در زیر به 5 نوع از پرکاربردترین آن ها پرداختیم.
1-3# سلول الکترولیتی
سلول الکترولیتی، سلول الکتروشیمیایی است که از طریق استفاده از انرژی الکتریکی، واکنش شیمیایی غیر خود به خودی را هدایت می کند.
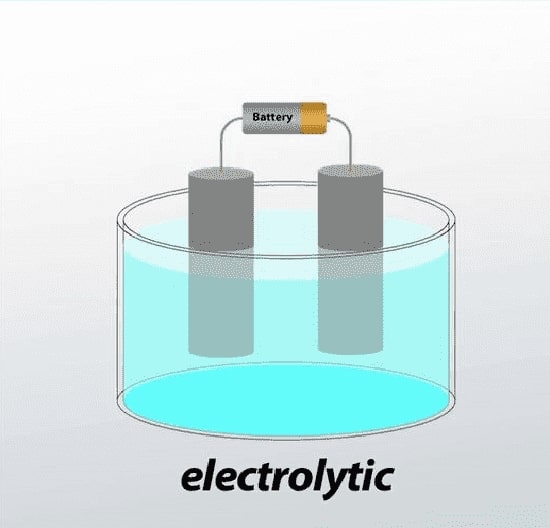
این اتفاق در فرآیندی به نام الکترولیز رخ می دهد.
بخش آخر لغت الکترولیز از یک کلمه یونانی lysis به معنی جدا شدن برگرفته شده است.
اغلب از الکترولیز برای تجزیه ترکیبات شیمیایی استفاده می شود.
الکترولیز در حقیقت تکنیکی است که از جریان الکتریکی مستقیم (DC) برای تجزیه مواد استفاده می کند.
تجزیه مواد شیمیایی از کاربرد های مهم الکترولیز است.
از تجزیه آب به هیدروژن و اکسیژن نیز می توان به عنوان پرکاربرد ترین نمونه های الکترولیز یاد کرد.
آبکاری (به عنوان مثال مس، نقره، نیکل یا کروم) با استفاده از سلول الکترولیتی انجام می شود.
یک سلول الکترولیتی دارای سه قسمت است: یک الکترولیت و دو الکترود (کاتد و آند).
الکترولیت معمولاً محلول آب یا حلال های دیگری است که یون ها در آن حل می شوند.
در بعضی موارد، از نمک های مذاب مانند کلرید اسید به عنوان الکترولیت استفاده می شود.
هنگامی که توسط ولتاژ خارجی اعمال شده به الکترودها هدایت اتفاق می افتد، یون های موجود در الکترولیت به الکترود با بار مخالف جذب می شوند.
به این طریق واکنش های انتقال بار در سلول الکترولیتی رخ می دهد.
فقط با یک پتانسیل الکتریکی خارجی (ولتاژ) با قطبیت صحیح و اندازه کافی، یک سلول الکترولیتی می تواند یک ترکیب شیمیایی را در محلول تجزیه کند.
در اصل، این فرآیند انرژی الکتریکی لازم برای راه اندازی یک واکنش شیمیایی غیر خود به خودی را تولید می کند.
2-3# سلول گالوانیک
سلول گالوانیک یا سلول ولتایی، یک سلول الکتروشیمیایی است که
انرژی الکتریکی را از واکنش های اکسایش خود به خودی که در داخل سلول اتفاق می افتد، به دست می آورد.
این سلول به طور کلی از دو فلز مختلف متصل شده توسط یک پل نمکی به هم متصل شده، تشکیل شده است.
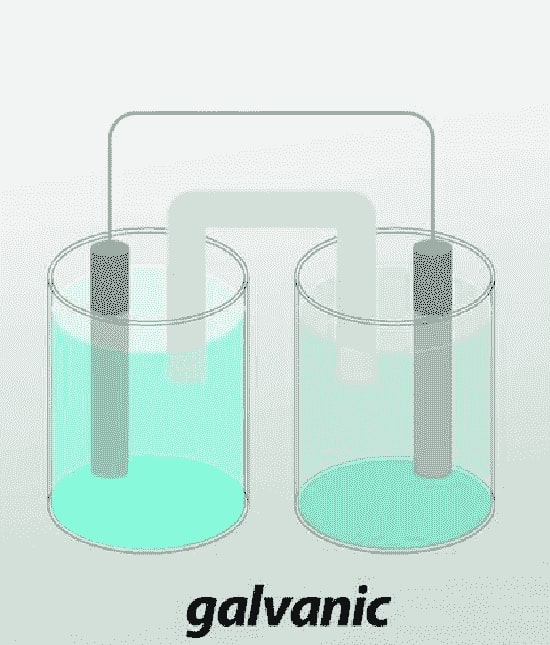
اولین سلول گالوانیکی که ساخته شد، یک باتری به نام شمع ولتایی بود که توسط ولتا اختراع شده بود.
در استفاده معمول، کلمه “باتری” شامل یک سلول گالوانیک است؛ هرچند که در واقعیت یک باتری از چندین سلول شیمیایی تشکیل شده است.
3-3# سلول اولیه
سلول اولیه به یک سلول الکتروشیمیایی از نوع سلول های گالوانیکی گفته می شود که
برخلاف سلول ثانویه و یا همان باتری قابل شارژ که می تواند با برق شارژ شود و مجدداً استفاده شود، برای یک بار استفاده و دور انداختن طراحی شده است.
به طور کلی، واکنش الکتروشیمیایی رخ داده در سلول برگشت پذیر نیست و سلول را غیر قابل شارژ می کند.
وقتی یک سلول به عنوان یک سلول اولیه استفاده می شود، واکنش های شیمیایی در باتری، مواد شیمیایی تولید کننده انرژی را مصرف می کنند.
وقتی آن ها از بین رفتند، باتری تولید برق را متوقف می کند و بلااستفاده می شود.
سلول های اولیه برای تأمین انرژی لوازم خانگی کوچک مانند چراغ قوه و رادیوهای قابل حمل در اندازه های استاندارد ساخته می شوند.
سالانه حدود 15 میلیارد باتری اولیه در سراسر جهان دور ریخته می شود که
همه آن ها در نهایت محل دفن زباله ها به پایان می رسند.
با توجه به فلزات سنگین سمی و اسیدهای قوی یا قلیایی موجود در آن ها، باتری ها زباله های خطرناکی هستند.
در نتیجه، بیشتر شهرداری ها آن ها را به عنوان زباله های خطرناک طبقه بندی می کنند که نیاز به دفع جداگانه دارند.

انرژی مورد نیاز برای تولید باتری حدود 50 برابر بیشتر از انرژی موجود در آن است.
به دلیل محتوای آلاینده زیاد آن ها در مقایسه با مقدار کم انرژی تولید شده توسط آن ها، باتری های اولیه یک فناوری هدر دهنده و ناسازگار با محیط زیست محسوب می شود.
4-3# سلول ثانویه
یک سلول ثانویه، که معمولاً به عنوان باتری قابل شارژ شناخته می شود، یک سلول الکتروشیمیایی است که
می تواند هم به عنوان یک سلول گالوانیک و هم به عنوان یک سلول الکترولیتی کار کند.
عمدتا به دلیل افزایش فروش دستگاه های بی سیم و ابزارهای بی سیم که نمی توانند از طریق باتری های اولیه تأمین شوند و ب
ا باتری های قابل شارژ یکپارچه عرضه می شوند، صنعت باتری های ثانویه رشد زیادی داشته و
به آرامی جایگزین باتری اصلی در محصولات پیشرفته می شود.

5-3# سلول سوختی
سلول سوختی، یک نوع سلول الکتروشیمیایی است که انرژی شیمیایی را از طریق سوخت به برق تبدیل می کند.
این عمل از طریق واکنش الکتروشیمیایی سوخت هیدروژن با اکسیژن یا یک عامل اکسید کننده دیگر انجام می شود.
سلول های سوختی از نظر نیاز به منبع مداوم سوخت و اکسیژن برای حفظ واکنش شیمیایی متفاوت با باتری ها هستند چرا که
در یک باتری، انرژی شیمیایی از مواد شیمیایی موجود در باتری تأمین می شود.
سلول های سوختی می توانند تا زمانی که سوخت و اکسیژن تامین می شود، به طور مداوم برق تولید کنند.
اولین سلول سوختی در سال 1838 اختراع شد و
اولین استفاده تجاری از سلول های سوختی بیش از یک قرن بعد در برنامه های فضایی ناسا برای تولید نیرو برای ماهواره ها و کپسول های فضایی صورت گرفت.
از آن زمان، سلول های سوختی در بسیاری از کاربردهای دیگر مورد استفاده قرار گرفتند.
سلول های سوختی برای برق اولیه و پشتیبان ساختمان های تجاری، صنعتی و مسکونی و در مناطق دور افتاده استفاده می شوند.
آنها همچنین برای تأمین انرژی وسایل نقلیه سوختی، از جمله اتومبیل، اتوبوس، قایق، موتور سیکلت و زیردریایی استفاده می شوند.
انواع مختلفی از سلول های سوختی وجود دارد.
با این حال، همه آن ها از یک آند، یک کاتد و یک الکترولیت تشکیل شده اند که
اجازه می دهند یون های هیدروژن با بار مثبت (پروتون ها) بین دو طرف پیل سوخت حرکت کنند.
نظرتون درباره این مقاله چیه؟
ما رو راهنمایی کنید تا اون رو کامل تر کنیم و نواقصش رو رفع کنیم.
توی بخش دیدگاه ها منتظر پیشنهادهای فوق العاده شما هستیم.


