قانون دالتون یکی از قوانین مهم در خصوص گازها است.
هر یک از قوانین گازها در تلاش هستند تا رابطه بین متغیرهای مختلف ذرات گاز را بیابند.
دالتون در این قانون دست روی فشار جزئی گازها گذاشته است.
در این مطلب قصد داریم به بحث درباره قانون دالتون بپردازیم.
تا پایان این مقاله با ما همراه باشید.
1# معرفی قانون دالتون (Dalton’s Law)
تصور کنید که می خواهیم به کمک یک فشارسنج، فشار هوای درون یک تیوب لاستیکی را اندازه گیری کنیم.
در این حالت ما مشغول اندازه گیری یک ویژگی فیزیکی ماکروسکوپیک (macroscopic) ذرات گازی هستیم که برای چشم غیرمسلح نامرئی هستند.
فشار درواقع نیرویی است که از برخورد مولکول های گاز منفرد با یکدیگر یا سایر اجسام ایجاد می شود.

برای بیان قانون دالتون قبل از هر چیزی لازم است به این نکته اشاره کنیم که مطابق این قانون می توان تمام گازها را گاز ایده آل در نظر گرفت.
منظور از گاز ایده آل گازی است که ذرات تشکیل دهنده آن هیچ نیروی برهمکنشی به یکدیگر وارد نمی کنند.
علاوه بر آن مولکول های گاز حجمی را اشغال نمی کنند.
در شرایط واقعی نیز تا زمانی که دمای گاز خیلی پایین نباشد و فشار در محدوده 1 اتمسفر قرار بگیرد، فرض ایده آل بودن گازها منطقی است.
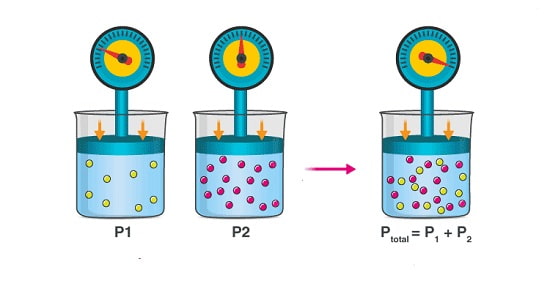
بر اساس این فرض می توان سهم گازهای مختلف در یک مخلوط از گازها را برای رسیدن به فشار کل تعیین کرد.
فشار ناشی از ورود یک گاز در مخلوطی از گازها را فشار جزئی می نامند.
مطابق قانون دالتون، فشار کل مخلوط گازها از حاصل جمع فشار جزئی هر یک از گازهای موجود در آن به دست می آید.
تصور کنید که در یک ظرف مخلوطی از سه گاز 1، 2 و 3 وجود داشته باشد.
در این شرایط فشار کل به صورت زیر محاسبه می شود:
PT = P1 + P2 + P3
2# تاریخچه قانون دالتون
جان دالتون علاقه بسیار زیادی به بررسی خصوصیات ذرات گاز داشت.
او در سال 1800 به مطالعه ماهیت و ترکیب شیمیایی هوا پرداخت.
در بررسی های او مشخص شد که هوا سیستمی متشکل از چندین ذره کوچک جداگانه است.
همچنین دالتون به این نکته مهم پی برد که می توان از فشار هر یک از اجزای تشکیل دهنده هوا به طور جداگانه استفاده کرد.
در نهایت او با انجام آزمایش های گوناگون کشف کرد که فشار کل هوا با مجموع فشارهای جزئی گازهای تشکیل دهنده آن برابر است.
این کشف او در سال 1803 میلادی تحت عنوان قانون دالتون به صورت رسمی ثبت شد.

3# مثالی از قانون دالتون
اجازه دهید که با مثالی به بررسی قانون دالتون بپردازیم.
تصور کنید که ترکیبی از گازهای هیدروژن و اکسیژن را در یک مخزن در اختیار داریم.
در این مخزن تعداد مول هیدروژن و اکسیژن به ترتیب برابر با 6.7 و 3.3 است.
همچنین حجم مخزن 300 لیتر است و در دمای 273 کلوین قرار دارد.
فشار کل مخزن نیز برابر با 0.75 اتمسفر است.
مطابق با قانون دالتون می توان فشار هر یک از گازهای هیدروژن و اکسیژن موجود در ظرف را به طور جداگانه محاسبه کرد.
در اینجا ما قصد داریم فشار گاز هیدروژن را محاسبه کنیم.
برای این منظور باید از رابطه زیر استفاده کنیم:
PH2V = nH2RT
هر یک از کمیت های موجود در رابطه فوق عبارت اند از:
- PH2: فشار جزئی هیدروژن
- V: حجم مخزن
- nH2: تعداد مول هیدروژن
- R: ثابت گازها
- T: دمای مخزن
بر این اساس فشار جزئی هیدروژن به صورت زیر محاسبه می شود:
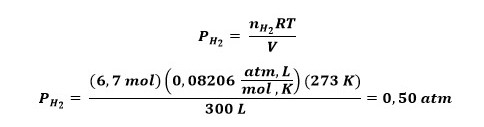
بنابراین فشار جزئی هیدروژن موجود در مخزن برابر با 0.5 اتمسفر است.
بر اساس قانون دالتون می توان فشار جزئی اکسیژن را نیز به صورت زیر محاسبه کرد:
Po2 = 0.75 – 0.5 = 0.25 atm
جمع بندی
در این مطلب به معرفی قانون دالتون پرداختیم.
نکته مهمی که لازم است در پایان اشاره کنیم، این است که
حتما در زمان استفاده از هر کدام از قوانین گازها مفروضاتی که باید برای آن ها در نظر بگیرید را لحاظ کنید.
در غیر این صورت به نتایج درستی دست پیدا نخواهید کرد.
 |
نظرتون درباره این مقاله چیه؟
ما رو راهنمایی کنید تا اون رو کامل تر کنیم و نواقصش رو رفع کنیم.
توی بخش دیدگاه ها منتظر پیشنهادهای فوق العاده شما هستیم.


