گاز ایده آل مفهومی انتزاعی است که برای ساده سازی تحلیل ذرات گاز مورد استفاده قرار می گیرد.
بسیاری از روابط فیزیکی و شیمیایی درباره گازها از گذشته تا به امروز با فرض ایده آل بودن گازها تعریف شده اند.
جالب است بدانید که در بسیاری مواقع نتایج حاصل از این فرضیه با آنچه در واقعیت اتفاق می افتد، سازگاری خوبی دارند.
در این مطلب قصد داریم به بررسی مفهوم این فرضیه بپردازیم.
تا پایان این مقاله ما را همراهی کنید.
1# گاز ایده آل چیست؟ (Ideal Gas)
یک مخزن مملو از ذرات گاز را تصور کنید.
در این مخزن میلیاردها مولکول گاز با سطح انرژی مختلف در کنار یکدیگر حضور دارند.
ذرات گاز با یکدیگر برخورد می کنند و اصطلاحا با هم برهمکنش دارند.
به همین دلیل تحلیل هر یک از این مولکول ها به صورت جداگانه برای بررسی رفتار کلی گازها کار بسیار دشواری است.
مفهوم گاز ایده آل از همین جا به وجود آمده است.
این مفهوم یک فرض انتزاعی است که برای دستیابی به تقریب مناسبی از تحلیل گازها تعریف شده است.
به کمک این فرضیه می توان رفتار گازها را با دقت قابل قبولی بررسی کرد.
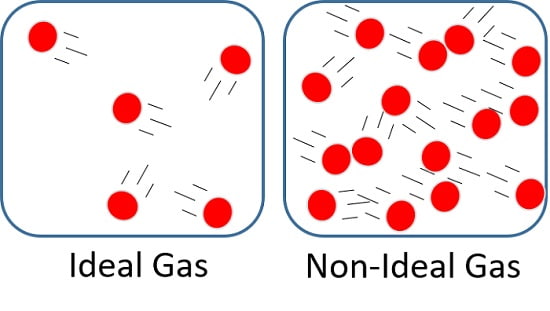
این اصطلاح دربردارنده دو فرض کلی است که در این جا اشاره می کنیم:
- عدم جاذبه یا دافعه مولکول های گاز
مولکول های گاز به هیچ عنوان یکدیگر را جذب یا دفع نمی کنند.
تنها برهمکنش بین مولکول های گازهای ایده آل، برخورد الاستیک (elastic collision) ذرات با یکدیگر یا با بدنه ظرف است.
- حجم نداشتن مولکول های گاز
هر یک از مولکول های گاز ایده آل به تنهایی حجم ندارند.
بلکه به عنوان نقاط تقریبی پراکنده در فضا در نظر گرفته می شوند.
البته این فرض صرفا در خصوص مولکول ها مطرح می شود و شامل حال مجموعه ذرات گاز در کنار یکدیگر نمی گردد.
اساسا مجموعه ذرات گاز حجم دارند و بسته به حجم ظرف، منبسط می شوند.
2# ارزیابی این فرضیه
احتمالا با مطالعه مقاله تا به این جا این سؤال در ذهن شما هم نقش بسته که فرضیه گاز ایده آل تا چه اندازه درست است.
واقعیت این است که هیچ گازی وجود ندارد که دقیقا مشخصات فوق را داشته باشد.
اما تعداد زیادی گاز در محیط اطراف ما تا حد قابل توجهی به مشخصات فوق نزدیک هستند.
به همین دلیل در تحلیل مسائل می توان با تقریب قابل قبولی آن ها را در جایگاه گازهای ایده آل قرار داد.
به طور کلی در محدوده دمای اتاق و فشار نزدیک به اتمسفر، بسیاری از گازهای مهمی که در زندگی با آن ها سروکار داریم، رفتار ایده آل از خود بروز می دهند.
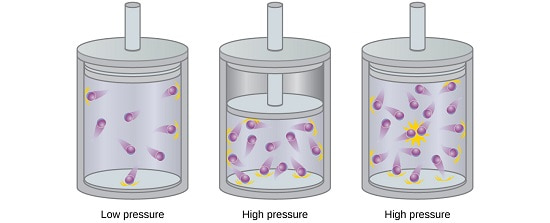
در شرایطی که فشار گاز به شدت افزایش پیدا کند (High Pressure) یا دمای محیط به طرز فاحشی کاهش یابد،
انحرافات جدی از مشخصات گازهای ایده آل در رفتار گازها مشاهده می شود.
در این شرایط است که استفاده از فرض ایده آل بودن گاز نتایج مطلوبی را به دنبال نخواهد داشت.
3# قانون گاز ایده آل به صورت مولی
قانون گاز ایده آل برای تعریف این فرضیه به صورت ریاضی ابداع شده است.
سه مؤلفه دما (T)، فشار (P) و حجم (V) پای ثابت روابط ریاضی هستند که در ارتباط با این گازها بیان می شوند.
رابطه قانون گازهای ایده آل در فرمت مولی به صورت زیر تعریف می شود:
PV = nRT
در رابطه فوق n معرف تعداد مول گاز و R نیز ثابت جهانی گازها است.
ثابت جهانی گازها با دو مقدار ثابت در رابطه فوق قابل استفاده است که عبارت اند از:
- R = 8.31 (J/K.mol)
- R = 0.082 (L.atm/K.mol)
اگر در رابطه فوق از R = 8.31 (J/K.mol) استفاده کنیم،
باید دما با یکای کلوین (K)، فشار با یکای پاسکال (Pa) و حجم با یکای مترمکعب (m3) باشند.
اما اگر از R = 0.082 (L.atm/K.mol) استفاده کنیم،
باید دما با یکای کلوین (K)، فشار با یکای اتمسفر (atm) و حجم با یکای لیتر (L) باشند.
4# قانون گاز ایده آل به صورت مولکولی
رابطه قانون گاز ایده آل با فرمت مولکولی به صورت زیر تعریف می شود:
PV = NkT
در رابطه بالا، N معرف تعداد مولکول های گاز و k نیز نماد ثابت بولتزمن (Boltzmann) است.
ثابت بولتزمن برابر با (J/K) 1.38×10-23 است.
بر این اساس در رابطه فوق دما با یکای کلوین (K)، فشار با یکای پاسکال (Pa) و حجم با یکای مترمکعب (m3) به کار می روند.
5# قانون گاز ایده آل به صورت نسبی
قانون گاز ایده آل به یک شکل رایج دیگر نیز در مسائل مختلف به کار می رود.
در صورتی که تعداد مول یا مولکول های ذرات گاز در یک مسئله تغییر نکنند، حاصل Nk یا Nr در روابط ریاضی فوق ثابت باقی می مانند.
بر این اساس اگر متغیر دما را از هر دو رابطه فوق به سمت چپ تساوی منتقل کنیم، رابطه زیر به دست می آید:
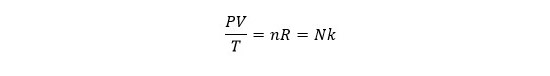
بر اساس رابطه فوق، نسبت حاصل ضرب فشار در حجم تقسیم بر دما در گاز همواره ثابت باقی می ماند.
این رابطه نسبی در تحلیل مسائل مختلف مرتبط با گازها بسیار مفید است.
جمع بندی
در این مطلب به بررسی مفهوم قانون گاز ایده آل پرداختیم.
همان طور که مشاهده کردید، این قانون در ریاضی با سه فرمت پرکاربرد مورد استفاده قرار می گیرد.
این قانون پایه و اساس بسیاری از تحلیل های علمی در مواجهه با گازها است.
 |
اگر به دنبال یاد گرفتن مهارت بیشتر و افزایش درآمد هستید،
برای دریافت آموزش های رایگان مرتبط با حوزه علاقهمندی خود فقط کافیه فرم رو تکمیل کنید.
نظرتون درباره این مقاله چیه؟
ما رو راهنمایی کنید تا اون رو کامل تر کنیم و نواقصش رو رفع کنیم.
توی بخش دیدگاه ها منتظر پیشنهادهای فوق العاده شما هستیم.







ثبت ديدگاه