قوانین گازها برای تحلیل پدیده های فیزیکی در خصوص ذرات معلق گازها کاربرد دارند.
البته هر یک از این قوانین محدوده عملکرد خاص خود را دارند.
در این مقاله قصد داریم ضمن معرفی این قوانین، محدوده کاربرد هر یک از آن ها را نیز بررسی کنیم.
تا انتها با ما همراه باشید.
1# خواص فیزیکی در تعریف قوانین گازها
قبل از معرفی قوانین گازها باید به این موضوع اشاره کنیم که
چه متغیرهای فیزیکی در تعریف این قوانین به کار می روند.
به طور کلی 4 متغیر فیزیکی اساسی در این زمینه کاربرد دارند که عبارت اند از:
- حجم (Volume)
حجم گاز به فضایی گفته می شود که توسط ذرات آن در یک محیط اشغال می شود.
همان طور که می دانید ذرات گاز مانند مایعات شکل ظرف را به خود می گیرند.
فرض کنید که در یک کپسول با حجم مشخص مقداری گاز وجود دارد.
اگر این گاز را به کپسول دیگری با فضای کوچک تر منتقل کنیم، ذرات گاز فشرده می شوند.
بنابراین در بررسی قوانین گازها باید حجم آن ها را مدنظر قرار داد.
- دما (Temperature)
دمای گاز دومین متغیری است که در تحلیل گازها مورد استفاده قرار می گیرد.
افزایش دما می تواند جنبش ذرات گاز را افزایش دهد.
در نتیجه باعث افزایش حجم آن می گردد.
عکس این قضیه نیز کاملا صادق است و با کاهش دما نیز حجم آن ها کم می شود.
- فشار (Pressure)
فشار نیز تحت عنوان نیرو بر واحد سطح تعریف می شود.
برای تعریف قوانین گازها باید حتما فشار را نیز مورد بررسی قرار داد.
- مقدار گاز یا مول (Mole)
مقدار گاز موجود در یک محیط نیز عامل بعدی است که باید برای تحلیل آن مد نظر قرار داد.
طبیعی است که هر چه مقدار گاز در یک ظرف با حجم مشخص بیشتر باشد، فشار آن ها افزایش می یابد.

2# قوانین گازها (Gases Laws)
شاید این سؤال برای شما هم پیش آمده باشد که قوانین گازها از کجا آمده اند.
واقعیت این است که عمده این قوانین حاصل مطالعات تجربی روی گازها هستند.
به این معنی که فیزیکدانان با بررسی رفتار گازها در شرایط مختلف متوجه شدند که نوعی رفتار مشابه از آن ها سر می زند.
با ذکر این توضیح قوانین گازها را در ادامه بررسی می کنیم.
1-2# قانون بویل (Boyle’s Law)
قانون بویل توسط فردی به نام رابرت بویل معرفی شد.
بویل در جریان بررسی های رفتار گازها در شرایط مختلف متوجه شد که
در شرایط دمای ثابت، بین حجم و فشار گازها رابطه معکوس وجود دارد.
به عنوان مثال او متوجه شد اگر در دمای ثابت، فشار گاز را دو برابر کنیم، حجم آن نصف می شود.
از این رو قانون بویل به عنوان یکی از قوانین گازها مطرح شد که رابطه ریاضی آن به صورت زیر تعریف می شود:
P * V = K
در رابطه فوق K عدد ثابت است و برای هر گاز مقدار مشخصی دارد که هیچ گاه تغییر نمی کند.
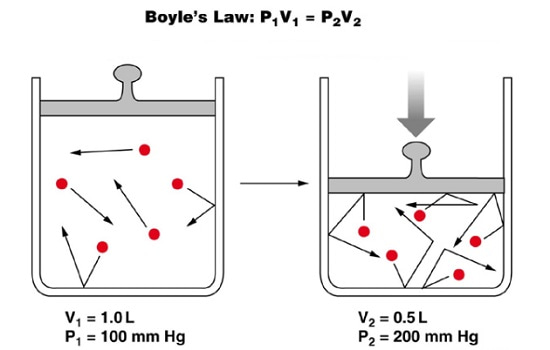
همان طور که در تصویر فوق مشخص است، در دمای ثابت با کاهش حجم ظرف از 1 لیتر به 0.5 لیتر (L)، فشار نیز از 100 میلی متر جیوه (mm Hg) به 200 میلی متر جیوه افزایش پیدا کرده است.
لذا حاصل ضرب فشار در حجم در حالت اول و دوم با هم برابر است.
2-2# قانون شارل در ردیف قوانین گازها (Charles’s Law)
قانون شارل یکی دیگر از قوانین گازها است که توسط فیزیکدانی به نام ژاک شارل معرفی شد.
این قانون روی رابطه بین دما و حجم گاز تمرکز می کند.
فرض کنید جرم مشخصی از یک گاز را در فشار ثابت در اختیار داریم.
در ادامه ذرات گاز را حرارت می دهیم.
به این ترتیب دمای آن افزایش پیدا می کند.
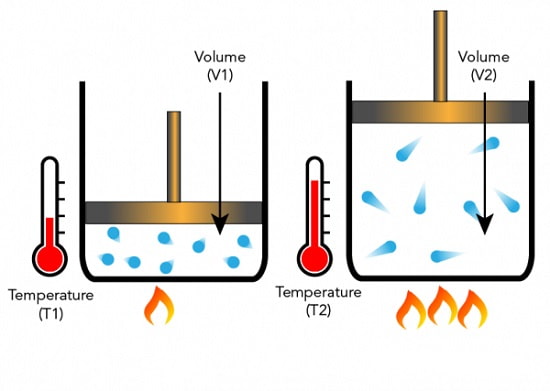
افزایش دما باعث افزایش انرژی جنبشی ذرات گاز نیز می شود.
در نتیجه موجب برخورد بیشتر ذرات گاز با هم می گردد و در پی آن حجم گاز افزایش می یابد.
رابطه بین دما و حجم گاز در فشار ثابت رابطه خطی و مستقیم است.
رابطه ریاضی قانون شارل به صورت زیر می باشد:
V/T = K
توجه داشته باشید که در رابطه فوق دما حتما باید در واحد کلوین قرار داده شود.
ولی برای حجم از هر یکایی می توان استفاده کرد.
3-2# قانون گی لوساک در بین قوانین گازها (Gay-Lussac’s Law)
ژوزف گی لوساک کسی بود که قانون جدیدی را به مجموعه قوانین گازها افزود.
تمرکز او در کشف این قانون روی رابطه بین فشار و دمای گازها معطوف بود.
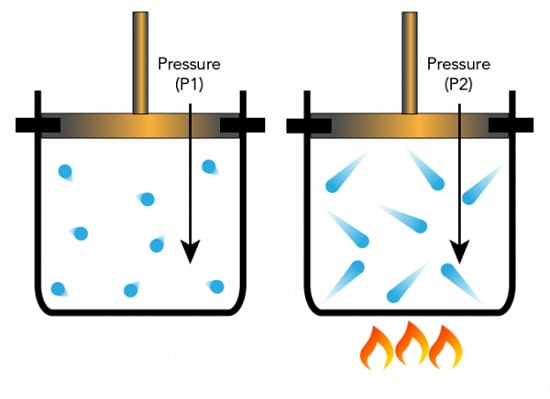
او مقدار مشخصی گاز را در ظرف با حجم ثابتی قرار دارد.
در ادامه آن را در معرض حرارت قرار دارد.
با توجه به این که در این حالت افزایش حجم امکان پذیر نبود، افزایش دما به طور مستقیم موجب افزایش فشار گاز شد.
بنابراین در قانون گی لوساک این طور بیان می شود که
در حجم ثابت، حاصل تقسیم فشار بر دمای گاز (با واحد کلوین) همواره عدد ثابتی است.
رابطه ریاضی آن را نیز می توان به صورت زیر بیان کرد:
P/T = K
4-2# قانون ترکیب گازها (Combined Gas Law)
تا این جا قوانین گازها را در شرایطی بررسی کردیم که همواره متغیر جرم به همراه یکی دیگر از متغیرها ثابت بود.
قانون ترکیب گازها در شرایطی بررسی می شود که فقط جرم گاز ثابت باقی می ماند.
اما سایر متغیرها از جمله فشار، حجم و دما تغییر می کنند.
در چنین شرایطی رابطه ریاضی بین این سه متغیر در گاز به صورت زیر تعریف می شود:
P * V / T = K
بنابراین تغییر هر یک از متغیرهای فوق باعث می شود که دو متغیر دیگر نیز دست خوش تغییر شوند.
به این معنی که اگر ما گازی در دما، فشار و حجم مشخص داشته باشیم و سپس دما و حجم آن ها را تغییر دهیم،
با توجه به رابطه فوق می توان فشار گاز را نیز در شرایط جدید به دست آورد.
5-2# قانون گاز ایده آل، معروف ترین قوانین گازها (Ideal Gas Law)
در ادامه بحث قوانین گازها به قانون گاز ایده آل می رسیم.
منظور از گاز ایده آل نوعی گاز است که ذرات معلق آن بر هم کنشی نسبت به یکدیگر ندارند.
هر چند که در واقعیت گاز ایده آل وجود خارجی ندارد.
اما برای ساده سازی تحلیل های فیزیکی این مفهوم انتزاعی برای برخی از گازها مورد استفاده قرار می گیرد.
در قانون گاز ایده آل دیگر خبری از ثابت باقی ماندن هیچ کدام از چهار متغیر جرم، دما، حجم و فشار نیست.
در چنین شرایطی رابطه ریاضی گازهای ایده آل به صورت زیر تعریف می شود:
P*V = n*R*T
در رابطه فوق حرف n معرف تعداد مول های گاز است.
همچنین R نیز ثابت جهانی گازها است که همواره مقدار ثابتی دارد.
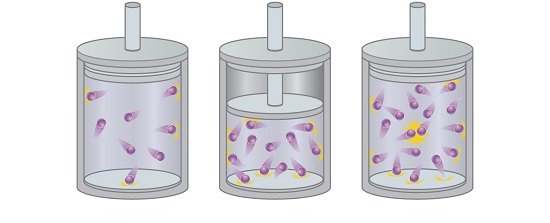
6-2# قانون دالتون یا فشار جزئی گازها (Dalton’s Law)
قانون دالتون یکی دیگر از قوانین گازها است که در فضایی متفاوت با 5 قانون قبلی قرار دارد.
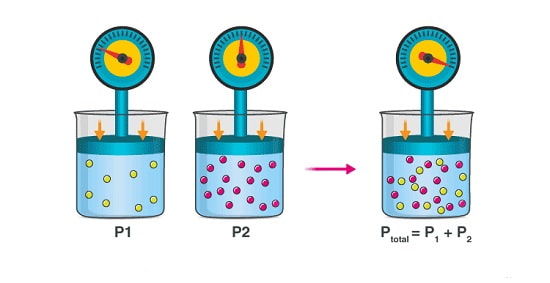
قانون دالتون بیان می کند که وقتی چند گاز با حجم مشخص را با یکدیگر ترکیب کنید،
فشار کل آن ها از مجموع فشارهای جزئی هر یک از گازهای موجود در ترکیب به دست می آید.
رابطه ریاضی قانون دالتون را نیز می توان به صورت زیر تعریف کرد:
…+PT=P1+P2
جمع بندی
در این مقاله به معرفی قوانین گازها پرداختیم.
باید توجه داشته باشید که قوانین فوق به صورت صد درصد صحیح نیستند.
بسته به نوع گاز و شرایط موجود، حتما روابط فوق با خطای نسبی همراه هستند.
اما برای ساده سازی تحلیل های فیزیکی فوق العاده کاربردی می باشند.
 |
نظرتون درباره این مقاله چیه؟
ما رو راهنمایی کنید تا اون رو کامل تر کنیم و نواقصش رو رفع کنیم.
توی بخش دیدگاه ها منتظر پیشنهادهای فوق العاده شما هستیم.



عالی
سلام همراه عزیز
ممنون از لطف شما