خوردگی فلزات و خرابی های در پی آن از موارد مهمی هست که باید توسط ابزارهایی مثل هافسل از رخ دادنشان جلوگیری کرد.
آیا این نام برای شما هم تازگی دارد و علت، نحوه استفاده و نقش آن در حفاظت کاتدی از فلزات را نمی دانید؟
با ما همراه باشید تا به سوال های شما در این باره پاسخ دهیم.
1# علت استفاده از نیمه سلول (Half-Cell)
خوردگی یک فرآیند طبیعی است، هنگامی رخ می دهد که سازه ای در معرض عناصری مانند CO2 یا کلرید باشد.
وقوع چنین واکنشی می تواند مثلا در صنعت ساختمان سازی، تا فولاد در بتن نفوذ کند و
این می تواند تهدید جدی برای دوام و ایمنی سازه باشد.
به همین دلیل مهم است که نظارت بر خوردگی، با استفاده از یک روش دقیق و قابل اعتماد انجام شود.
الکترومترها وسیله ای هستند که از دو نیم سلولی با کاربرد آسان تشکیل شده اند و
می توانند به راحتی شرایط و خوردگی احتمالی میلگردها و سازه های فولادی درون بتن را اندازه گیری کنند.
در این مقاله قصد داریم با بررسی چگونگی ارتباط پتانسیل های الکترود استاندارد با واکنش های ساده آن آشنا شویم و
به کارگیری هافسل به عنوان یکی از روش های مهم حفاظت کاتدی را برایتان توضیح دهیم.
در ادامه با ما همراه باشید…
2# هافسل چیست؟
یک سلول الکتروشیمیایی می تواند اجازه دهد که دو واکنش نیمه، به صورت جداگانه رخ دهند.
به این ترتیب الکترون ها از یک سیم خارجی از یک واکنش به واکنش دیگر عبور می کنند.
این اساس کار همه باتری ها و سلول های خشک است.
در یک قسمت از سلول، واکنش اکسیداسیون در حال انجام است و
در بخش دیگر، واکنش کاهش رخ می دهد.
الکترون هایی که در واکنش اکسیداسیون از بین رفته اند از طریق مدار خارجی به واکنش احیا می روند و
در آنجا عامل اکسید کننده را کاهش می دهند.
به دو قسمت سلول الکتروشیمیایی نیمه سلول یا همان هافسل (Half-Cell) گفته می شود.
انرژی به عنوان انرژی الکتریکی جایگزین گرما می شود.
باتری ها هر دو ترمینال مثبت و منفی دارند.
اختلاف پتانسیل بین ترمینال های مثبت و منفی بر حسب ولت اندازه گیری می شود.
 |
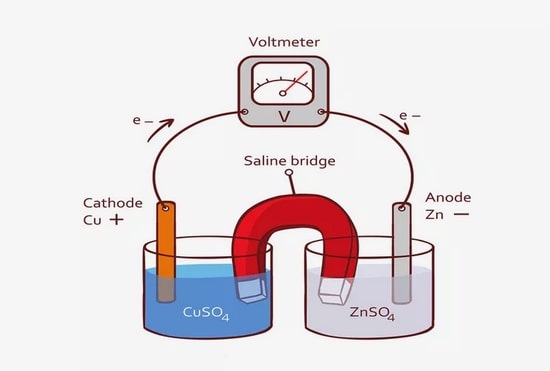
3# آزمایش هافسل روی و مس
در این قسمت از مقاله می خواهیم به بررسی مواردی بپردازیم که
اگر نیمی از سلول روی را با نیمه سلول مسی ترکیب کنید چه روی خواهد داد؟
با استفاده از نوارهای فلزی غوطه ور در محلول های یون های فلزی می توان یک سلول ساده ایجاد کرد.
به عنوان مثال، سلول مس و روی از دو نیمه سلول تشکیل شده است:

ارتباطی بین دو هافسل مورد نیاز است (هافسل ها نباید با هم مخلوط شوند).
یک نوار کاغذ صافی (پل نمک) آغشته به نیترات پتاسیم اشباع شده می تواند به عنوان محل اتصال بین دو نیم سلول استفاده شود.
پل نمک حاوی یون های مثبت و منفی است.
هر کدام از نیمه سلول ها منفی تر شوند (یعنی حاوی ماده اکسید کننده باشد) یون های مثبت را از پل نمکی دریافت می کند و
این بار را کاهش می دهد.
نیمه سلولی که مثبت تر می شود (یعنی آن که حاوی عامل احیا کننده است) یون های منفی را از پل نمکی دریافت می کند.
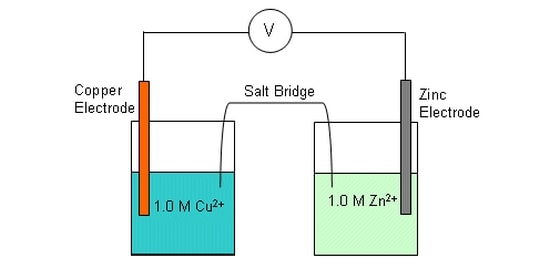
در یک هافسل، یک واکنش تعادلی در سطح الکترود اتفاق می افتد.
به عنوان مثال در هافسل روی واکنش زیر اتفاق می افتد.
+Zn(s) + 2e– = Zn2
هنگامی که دو هافسل به هم متصل شوند، گونه هایی که بیشترین واکنش را دارند بیشترین تمایل را برای تشکیل یون ها دارند یعنی
تبدیل به عامل کاهنده می شوند.
وقتی هافسل روی به هافسل مس متصل شود، یون های مس الکترون را می پذیرند زیرا
آن ها عامل اکسید کننده قوی تری هستند.
این موقعیت تعادل در نیمه واکنش، مس را به سمت راست تغییر می دهد،
بنابر این منجر به کاهش یون های مس می شود:
(Cu2+ + 2e– = Cu(s
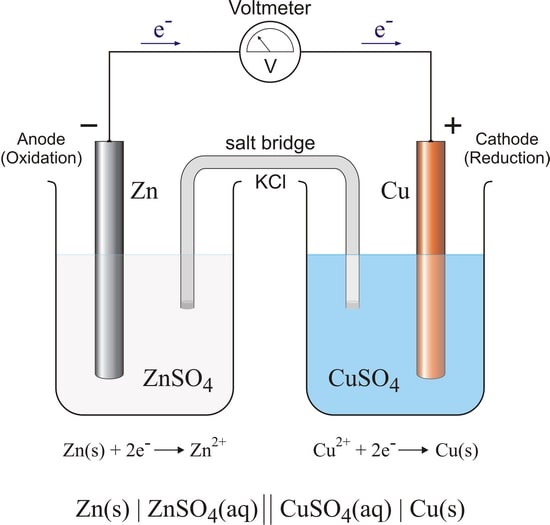
4# هافسل حفاظت کاتدیک
سلول های الکتروشیمیایی معمولاً از دو نیم سلول (هافسل) تشکیل شده اند.
نیم سلول ها نیمه واکنش اکسیداسیون را از نیم واکنش احیا جدا کرده و
جریان را از طریق یک سیم خارجی امکان پذیر می کند.
یک اکسیداسیون در هافسل آند رخ می دهد.
آند در نیم سلول دیگر به کاتد متصل است و کاهش در کاتد رخ می دهد.
با افزودن یک پل نمکی، مدار اجازه می دهد تا جریان جاری شود.
آنیون های موجود در پل نمکی به سمت آند و کاتیون های موجود در پل نمک به سمت کاتد جریان می یابند.
حرکت این یون ها مدار را کامل می کند و هر نیم سلول را از نظر الکتریکی خنثی نگه می دارد.
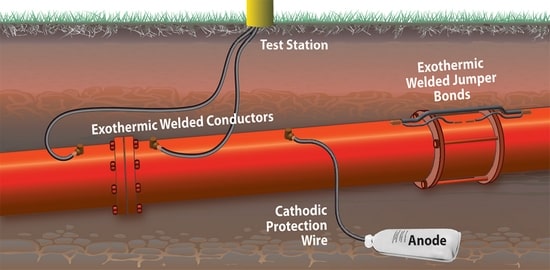
برای محافظت فعال، ما آندهای قربانی را نزدیک خطوط به زمین می آوریم.
سپس آن را به صورت رسانای الکتریکی به لوله متصل می کنیم.
جریان محافظ از آند به لوله ای که به عنوان کاتد عمل می کند، جریان می یابد.
دیگر هیچگونه خوردگی روی لوله وجود ندارد.
فقط آند در طول زمان به معنای واقعی کلمه خود را فدا می کند.
5# Half Cell Meter چیست؟

خوردگی فولاد یک فرآیند الکتروشیمیایی است که شامل مناطق آندی (خورنده) و کاتدی (منفعل) روی فلز است.
با اندازه گیری پتانسیل های الکتریکی سطح بتن نسبت به یک الکترود مرجع استاندارد روی یک شبکه از پیش تعیین شده، ممکن است وجود داشته و
محل خوردگی و عملکرد احتمالی آن در آینده ارزیابی شود.
چنین تشخیصی مناطقی را که خوردگی در آن وجود داشته باشد یا
ممکن است دچار خوردگی شود را مشخص می کند.
این کاوشگر از یک عنصر کلرید نقره – نقره بسیار پایدار محصور در الکترولیت ژل اشباع شده از یون کلرید تشکیل شده است.
این یک درپوش پیچ دار مجهز به یک پلاگین شیشه متخلخل برای هدایت یونی دارد.
این ابزار به طور خودکار پتانسیل های اندازه گیری شده را به عنوان پتانسیل های معادل مس – سولفات مس تبدیل و نمایش می دهد.
اگر به دنبال یاد گرفتن مهارت بیشتر و افزایش درآمد هستید،
برای دریافت آموزش های رایگان مرتبط با حوزه علاقهمندی خود فقط کافیه فرم رو تکمیل کنید.
نظرتون درباره این مقاله چیه؟
ما رو راهنمایی کنید تا اون رو کامل تر کنیم و نواقصش رو رفع کنیم.
توی بخش دیدگاه ها منتظر پیشنهادهای فوق العاده شما هستیم.







با سلام و احترام
مطالب شما بسیار مفید و عالی بود
آرزوی موفقیت روزافزون دارم
سلام همراه گرامی
از محبت و لطفی که به ما دارید بسیار متشکریم و خرسندیم که مطالب برای شما مفید واقع شدند.
رضایت شما مایه دلگرمی ما برای ادامه مسیر هست.
موفق باشید
بسیار عالی بود
سلام خدمت شما دوست عزیز
بسیار خرسند هستیم که از این مطالب رضایتمند هستید.
موفق و موید باشید.