اگر در جریان روزمره زندگی با مواد شیمیایی سر و کار دارید، احتمالا کلمه های اسید و باز را بسیار شنیده اید.
در واقع اکثر ما روزانه چه به طور مستقیم و چه غیرمستقیم با اسیدها و بازهای مختلف در ارتباط هستیم.
تمیزکردن وسایلمان و اسیدی که به طور مستقیم در معده ما وجود دارد همگی نشانه های نقش اثرگذار اسیدها و بازها در زندگی ما هستند.
پس برای شناخت این دسته از مواد و ویژگی های متعددشان در ادامه مقاله همراه ما باشید.
1# تعریف اسید (Acid)
در تعاریف مرتبط با اسید و باز، اسید به آن دسته از مولکول ها یا یون ها گفته می شود که
می توانند یک پروتون از دست بدهند یا به عبارت دیگر توانایی تشکیل پیوند کووالانسی با یک جفت الکترون را دارند.
جالب است بدانید که این مواد را بر اساس نام ترکیب غیرفلزی آن ها نام گذاری می کنند.
حال در ادامه به برخی از خواص مهم این مواد می پردازیم:
- در محلول آبی پروتون آزاد می کنند.
- ترش مزه هستند.
- کاغذ شناساگر را قرمز می کنند.
- pH کمتر از 7 دارند.

البته اسیدها را می توان با توجه به میزان تفکیک یون در آب به دو دسته قوی و ضعیف تقسیم کرد:
- اسیدهای قوی:
اسیدهایی هستند که به طور کامل در آب تفکیک یون می شوند و یون +H3O تولید می کنند.
از جمله این مواد می توان به موارد زیر اشاره کرد:
- هیدروکلریک
- هیدروبرمیک
- سولفوریک
- نیتریک
- اسیدهای ضعیف:
این دسته از مواد به طور کامل در آب تفکیک یون نمی شوند.
از جمله مهم ترین این مواد کاربردی موارد زیر می باشند:
- بوریک اسید
- کربنیک اسید
- هیدروسولفوریک اسید
- فسفریک اسید
- هیدروسیانیک اسید
2# تعریف باز (Base) یا قلیا
حال که با مفهوم اسید، انواع و خواص آن آشنا شدیم،
لازم است برای شناخت اسید و باز، به بررسی مفهوم، خواص و انواع بازها نیز بپردازیم.
در تعریف شیمیایی، باز به موادی گفته می شوند که در آب یون های هیدروکسید آزاد می کنند.
به عبارتی، موادی باز نام دارند که هنگام حلالیت در آب، pH محلول را به بیشتر از 7 افزایش دهند.
در ادامه به برخی خواص کلیدی بازها اشاره می کنیم:
- بازها عموما لغزنده هستند.
- مزه تلخی دارند.
- در صورت واکنش با اسیدها نمک تولید می کنند.
- خورنده هستند.
- محلول های آبی بازها رسانای الکتریکی هستند.
- کاغذ شناساگر را آبی می کنند.
- دارای pH بیشتر از 7 هستند.
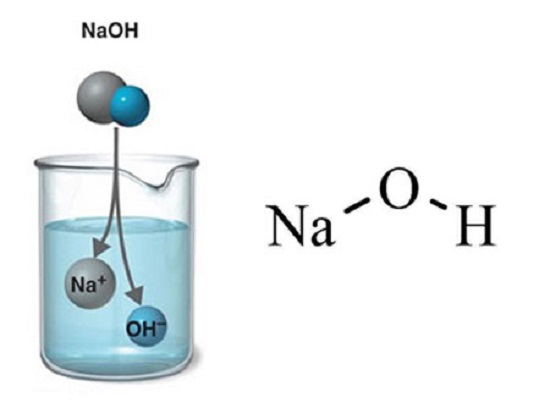
معروف ترین بازها عبارتند از:
- سدیم هیدروکسید: تولید صابون، کاغذ و فیبر
- کلسیم هیدروکسید: تولید پودر سفیدکننده
- سدیم کربنات: محلول شستشو
- آمونیوم هیدروکسید: حذف کننده لکه های لباس
- منیزیم هیدروکسید: به عنوان آنتی اسید برای درمان معده
- سدیم هیدروژن کربنات: بیکینگ پودر، کپسول آتش نشانی
3# نظریه های مرتبط با اسید و باز
در رابطه با این دسته بندی مواد، سه نظریه زیر در نظر گرفته شده است:
- آرنیوس
- برونستد-لوری
- لوییس
حال در ادامه به طور کامل این نظریه ها را بررسی می کنیم.
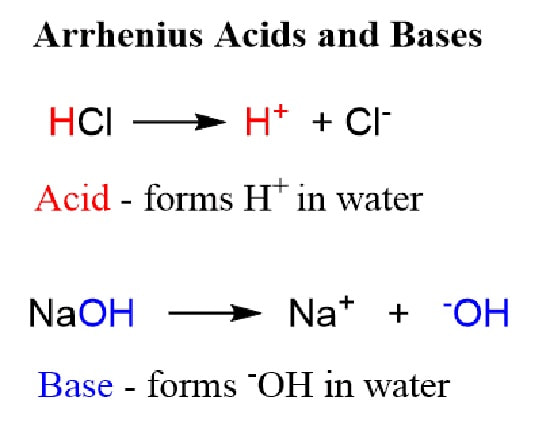
- نظریه آرنیوس
طبق این نظریه، به ترکیبی اسید می گویند که
با اضافه شدنش به آب، غلظت یون های +H افزایش پیدا کند و
هنگامی که با آب ترکیب می شود یون +H3O تشکیل دهد.
باز آرنیوس به ترکیبی گفته می شود که در محلول آبی، غلظت یون های –OH را زیاد کند.
پس متوجه شدیم اسید آرنیوس در آب یون هیدورژن آزاد می کند و
باز آرنیوس غلظت یون های هیدروکسید را در محلول آبی افزایش می دهد.
این نظریه چگونگی واکنش اسید و باز با هم و تولید آب و نمک را بررسی می کند.
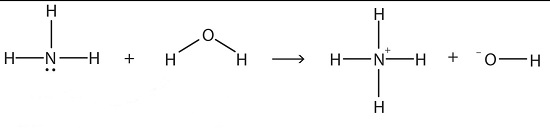
- نظریه برونستد لوری
طبق این نظریه، اسیدها پروتون دهنده و بازها پروتون گیرنده هستند.
اگر ماده ای هر دو خاصیت پروتون گیرنده و پروتون دهنده را داشته باشد، به آن آمفوتر می گویند.
هنگامی که یک اسید برونستد در آب حل شود، غلظت یون هیدورژن در آب افزایش پیدا می کند و
با افزودن یک باز برونستد به آب، مقدار یون هیدروکسید زیاد می شود.
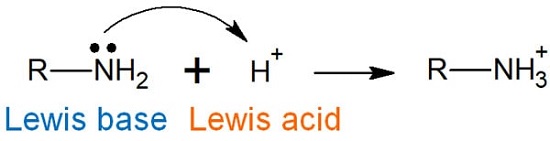
- نظریه لوییس
نظریه لوییس مهم ترین و کاربردی ترین نظریه است.
در واقع طبق این نظریه تعریف اسید و باز بسیار گسترده تر است و
محدود به غلظت یون های هیدروژن و هیدروکسید در آب نمی شود.
در این نظریه به جای استفاده از مفهوم پروتون، از انتقال الکترون ها صحبت می کنیم.
در واقع این جا اسید دارای اوربیتال خالی است و یک جفت الکترون را می پذیرد و
باز ذره ای است دارای یک جفت الکترون ناپیوندی که می تواند آن را اهدا کند.
4# مقایسه اسید و باز
در تعاریف فوق با انواع اسید و باز و نظریه های مرتبط با آن ها آشنا شدیم.
حال به عنوان خاتمه بحث وقت آن رسیده که اسیدها را با بازها مقایسه کنیم تا با تفاوت های آن ها نیز آشنا شویم.
اسیدها موادی ترش مزه هستند که کاغذ شناساگر را به رنگ قرمز در می آورند و
هنگام واکنش با بازها، آن ها را خنثی می کنند.
در حالی که بازها طعمی گس و تلخ دارند و هنگام تماس با دست مثل صابون لغزنده هستند.
بازها رنگ شناساگر را آبی می کنند و می توانند اسیدها را خنثی کنند.
از واکنش یک اسید و یک باز، نمک و آب تولید می شود.
 |
نظرتون درباره این مقاله چیه؟
ما رو راهنمایی کنید تا اون رو کامل تر کنیم و نواقصش رو رفع کنیم.
توی بخش دیدگاه ها منتظر پیشنهادهای فوق العاده شما هستیم.



از واکنش اسید با باز نمک و آب تولید می شود ، لطفا متن نوشته پایانی خودرا اصلاح فرمایید.
با تشکر
سلام جناب پورادبی گرامی
ممنون از دقت نظر شما و اعلام این اشتباه نوشتاری نویسنده، فرمایش شما کاملا صحیح هست و در متن مقاله اصلاح شد.
موفق باشید
خوب
سلام همراه گرامی
ممنون از محبت تون
موفق باشید
بسیار خوب
سلام جناب حقانی
ممنون از لطف شما
موفق باشید