برای آن که بفهمیم یون چیست باید به پیوندهایی که بین عناصر شکل می گیرند توجه کنیم و آن ها را مورد بررسی قرار دهیم.
این پیوندها می توانند تشکیل دهنده بسیاری از ترکیباتی باشند که در زندگی روزمره از آن ها استفاده می کنیم.
در این مقاله به توضیح کامل یون ها می پردازیم. با ما همراه باشید.
1# یون چیست؟
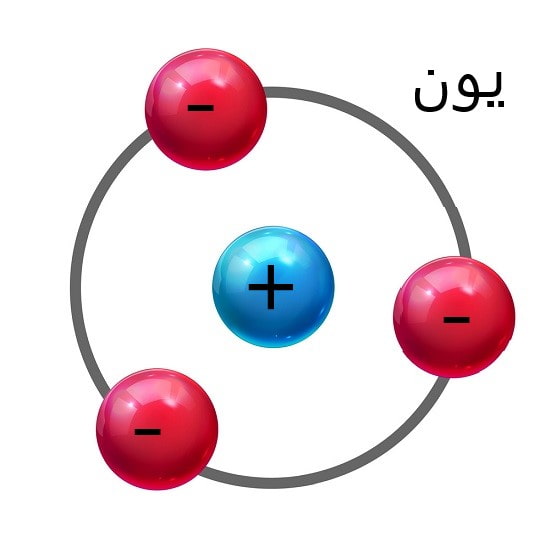
ما می توانیم یون (Ion) را به عنوان یک مولکول یا یک اتم باردار تعریف کنیم.
دلیل باردار شدن آن به دست آوردن یا از دست دادن یک یا چند الکترون است.
آن اتمی که الکترون از دست می دهد “بار مثبت” و آن اتمی که الکترون به دست می آورد، “بار منفی” می گیرد.
در واقع اصطلاح “یون” را می توان برای اشاره به اتم ها یا مولکول هایی استفاده کرد که بار آن ها غیرصفر است.
یون ها به غیر از داشتن بار مثبت یا منفی، توانایی پیوند با یکدیگر را نیز دارند.
اگر یک یون در مجاورت یون دیگری با بار مخالف قرار گیرد، بین این دو میدان مغناطیسی ایجاد خواهد شد.
یون ها دارای ویژگی هایی هستند که به آن ها اشاره می کنیم:
- یون ها می توانند براساس ویژگی محیط به اشکال مختلفی تبدیل شوند.
به عنوان مثال در فاز گازی، می توانند به صورت جداگانه و آزاد در محیط حرکت داشته باشند؛
اما در فازهای متراکم و یا محلول ها به صورت الکترولیت هستند و حرکت آن ها بسیار محدودتر است. - قطبی هستند.
- ویژگی مغناطیسی دارند.
- بسیار واکنش پذیر هستند.
- یون های گازی معمولاً تک اتمی هستند.
حال که متوجه شدیم یون چیست، به معرفی دو دسته کلی از آن می پردازیم.
2# دسته بندی یون ها
یون ها به طور کلی به دو دسته تقسیم می شوند که عبارتند از:
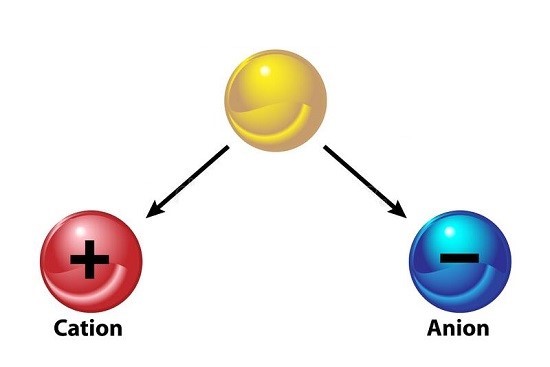
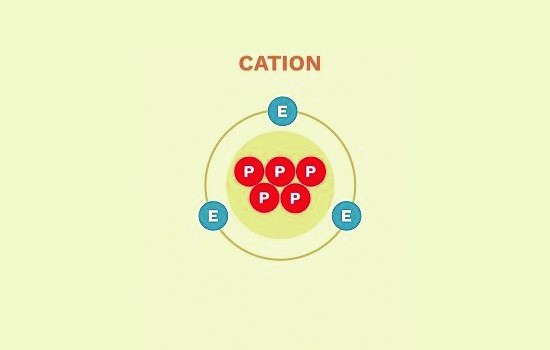
- کاتیون ها (Cation)
این ها یون هایی هستند که دارای بار مثبت می باشند؛
زیرا تعداد ذرات پروتون در این یون ها از تعداد الکترون های آن ها بیشتر است.
این یون ها تمایل به از دست دادن الکترون دارند.
یک کاتیون را با علامت + نمایش می دهند.
به عنوان مثال نماد شیمیایی +Ca2.
در این جا 2 عدد بار است، یعنی فرمول دارای کاتیونی با بار +2 است (در صورتی که هیچ عددی قبل از علامت مثبت وجود نداشته باشد، 1 فرض می شود و آن را نمی نویسند).
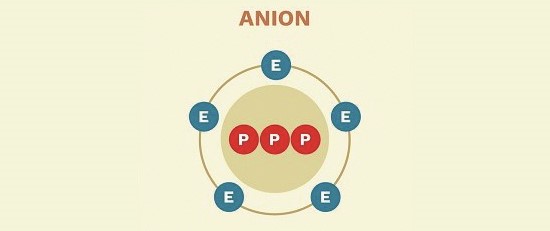
- آنیون ها (Anion)
این یون ها دارای بار منفی هستند؛ یعنی تعداد الکترون های یک آنیون از تعداد پروتون های آن بیشتر است و
در نتیجه آن را به یک یون دارای بار منفی تبدیل می کند.
آنیون ها تمایل به گرفتن الکترون دارند.
لازم به ذکر است که تعداد نوترون ها هنگام تعیین آنیون بودن یا نبودن یک اتم یا یک مولکول مهم نیست.
مشابه کاتیون ها، بار آنیون ها را نیز با یک عدد نشان می دهند؛ با این تفاوت که علامت آن – است.
به عنوان مثال، –Cl حامل یک آنیون است.
حالا که متوجه شدیم یون چیست و چه دسته بندی هایی دارد، به معرفی انواع یون ها می پردازیم.
3# انواع یون ها
- یون های تک اتمی (Monatomic Ion):
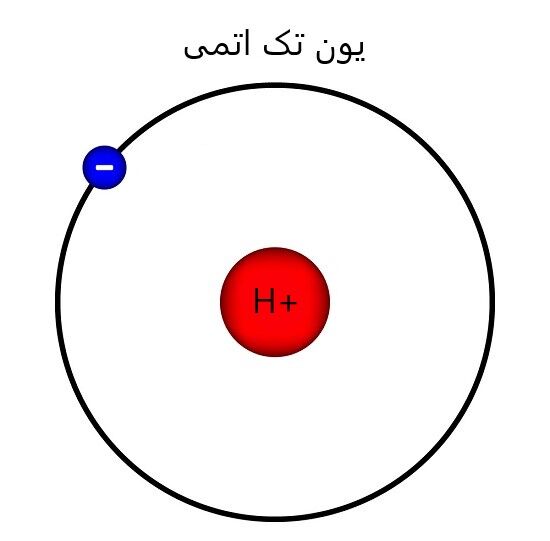
در صورتی که یون از یک اتم تشکیل شده باشد، به آن “یون تک اتمی” می گویند.
به عنوان مثال یون هیدروژن (+H) را در نظر بگیرید.
- یون های چند اتمی (Polyatomic Ion):
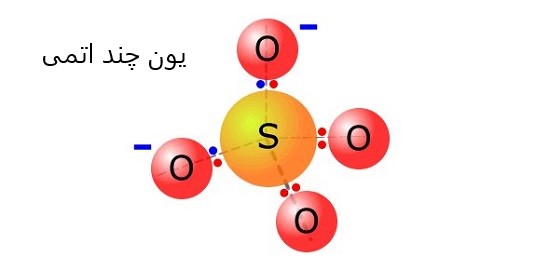
اگر یون از دو یا چند اتم تشکیل شده باشد، به آن “یون چند اتمی” می گویند.
به عنوان مثال می توان به یون گوگرد تری اکسید –SO3 اشاره کرد.
از آن جا که بیش از یک اتم دارد، به عنوان یون چند اتمی شناخته می شود.
یون های چند اتمی عموماً بسیار ناپایدار هستند.
در این بخش برای دریافت هر چه واضح تر پاسخ سوال “یون چیست” به بررسی انواع یون ها پرداختیم.
حال باید بدانیم که چه پیوند هایی این یون ها را به هم متصل می کنند.
4# پیوند یونی چیست؟
به طور کلی اتم ها دوست دارند ساختاری پایدار داشته باشند.
اتم ها برای رسیدن به ساختار پایدار، باید به آرایش گازهای نجیب دست پیدا کنند که
برای رسیدن به این آرایش می توانند با انتقال الکترون ها به اتم های دیگر و یا گرفتن الکترون ها از اتم های دیگر به وسیله پیوند یونی، اقدام کنند.
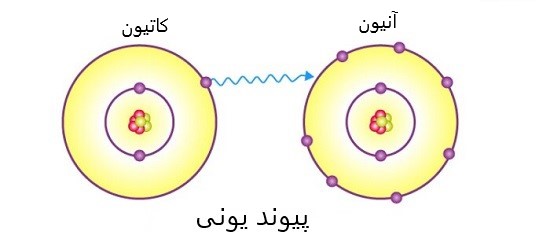
پیوندی که بین یون های غیرهمنام یعنی همان کاتیون و آنیون یا بهتر است بگوییم معمولاً بین فلز و نافلز تشکیل می شود، “پیوند یونی (Ionic Band)” نام دارد.
به این دلیل که فلزات یا همان کاتیون ها تمایل زیادی به از دست دادن الکترون دارند و
در مقابل آن ها، نافلزات یا آنیون ها نیز تمایل به گرفتن الکترون دارند،
این دو می توانند با هم تبادل الکترون داشته باشند تا هردو به ساختار پایداری برسند.
به عنوان مثال، عناصری که در گروه دوم قرار دارند در لایه ظرفیت خود دارای 2 الکترون هستند.
پس این عنصرها باید دو الکترون خود را از دست بدهند تا به آرایش گازهای نجیب دست پیدا کنند.
بر عکس این اتفاق هم ممکن است بیفتد.
برای مثال عناصر گروه هفدهم یا هالوژن ها (Halogens) دارای 7 الکترون در لایه ظرفیت خود هستند و
از آن جا که این عناصر جزء نافلزات به حساب می آیند، تمایل به گرفتن الکترون دارند.
پس فقط کافی است که 1 الکترون دریافت کنند تا به آرایش گاز نجیب برسند.
در راستای پاسخ به سوال یون چیست و شناخت پیوند بین یون ها، باید درباره تشکیل یون ها نیز اطلاعاتی داشته باشیم.
5# تشکیل یون ها
یون ها می توانند به دو روش تشکیل شوند که به آن ها اشاره می کنیم:
- تشکیل یون ها توسط فرآیند یونیزاسیون (Ionization)
یون ها می توانند با یونیزاسیون که فرآیند از دست دادن یا به دست آوردن الکترون است، تشکیل شوند.
یونیزاسیون به طور کلی شامل انتقال الکترون ها بین اتم ها یا مولکول ها است.
این فرآیند در نهایت باعث ایجاد پیوندهای پایدارتری می گردد.
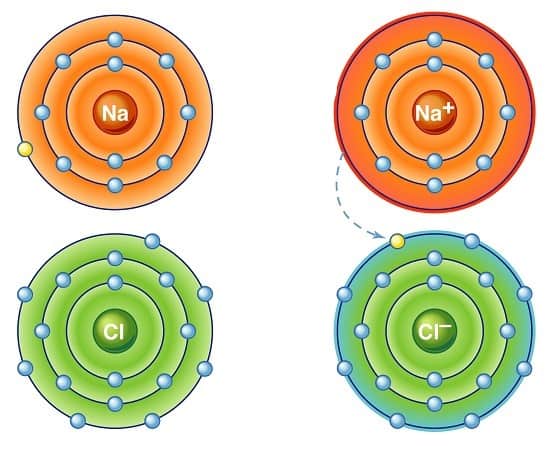
برای مثال، سدیم یک بار 1+ دارد؛ زیرا سدیم دارای 11 الکترون است و در لایه آخر خود فقط یک الکترون دارد.
پس سدیم با 10 الکترون پایدارتر خواهد بود؛ بنابراین سدیم تمایل به از دست دادن یک الکترون دارد تا پایدارتر شود.
از سوی دیگر، کلر تمایل دارد که الکترونی به دست آورد تا تبدیل به –Cl شود.
کلر به طور طبیعی دارای 17 الکترون است؛ اما با 18 الکترون پایدارتر خواهد بود؛
بنابراین، کلر یک الکترون از اتم دیگر می گیرد تا بار منفی پیدا کند.
- تشکیل یون ها توسط فعل و انفعالات شیمیایی (Chemical Interactions)
فرآیند مهم دیگری که از طریق آن می توان یون ایجاد کرد، فعل و انفعالات شیمیایی است.
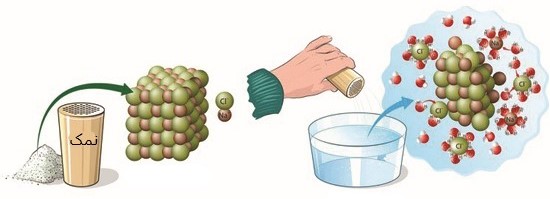
به عنوان مثال، هنگامی که یک ترکیب یونی مانند نمک در یک حلال مناسب (مانند آب) حل می شود،
اتم های تشکیل دهنده نمک تفکیک می شوند و یون های آزاد را تشکیل می دهند؛
یعنی کاتیون های سدیم و آنیون های کلرید تجزیه می گردند.
می توان اشاره کرد که کاتیون های سدیم را با نماد +Na و آنیون های کلرید را با نماد –Cl نشان می دهند.
 |
نظرتون درباره این مقاله چیه؟
ما رو راهنمایی کنید تا اون رو کامل تر کنیم و نواقصش رو رفع کنیم.
توی بخش دیدگاه ها منتظر پیشنهادهای فوق العاده شما هستیم.



واقعا عالی بود
سلام همراه گرامی
سپاس از محبت بیکران شما
موید باشید
مطالب خیلی مفید و خلاصه بود و به روشنی قابل فهم شده بود، ممنون
یونیزاسیون به چه صورتی انجام میشود منظورم چگونه cl- تبدیل میشود و یا سدیم Na به چی صورتی Na+ میشود که در نهایت نمک Naclبوجود میاید؟
ممنونم پاسخ بدید
سلام جناب مقدم کیا
ضمن تشکر از حضور شما در سایت ما
با عرض پوزش ما پشتیبان مجموعه آموزشی نماتک هستیم و درباره این مبحث تخصصی که شما سوال مطرح فرمودید دانش کافی رو نداریم تا پاسخگوی این سوال باشیم
به شما پیشنهاد میکنیم در تالار گفتگوی نماتک، با بیش از ۳۰۰۰ عضو فعال، به آدرس لینک زیر سوالتون رو مطرح بفرمایید تا عزیزانی که در این حوزه دانش و مهارت مرتبط دارند پاسخگوی شما باشند.
موید باشید
آدرس فروم نماتک: https://katibeha.com/